接種時期選定の参考 (新)


このページでは 免疫刷り込み(≒ 抗原原罪) (めんえきすりこみ、こうげんげんざい)について説明します。
「免疫刷り込み(≒ 抗原原罪)」と呼ばれているものは、次の(1)あるいは(2)の現象を指しているようです。
研究者によって、「免疫刷り込み = 抗原原罪」として扱ったり、「抗原原罪 =(1)、免疫刷り込み =(2)」としたり、「抗原原罪という用語はもう使わない、今後は免疫刷り込みを使う」としたり、いろいろのようです。
Wikipedia の説明 (2024.07.15)では:
抗原原罪とは、・・・、以前に感染したインフルエンザ株(A株とする)と一部同様のエピトープを持つインフルエンザ株(B株)に感染したとき、A、B共通のエピトープに対する抗体は迅速に産生されるものの、Bには存在するがAには存在しないエピトープに対する抗体は対応するナイーブB細胞(幼若なB細胞)が抑制されるので、産生される抗体の量が著しく低くなる現象のことである。
Aと同じエピトープを持たない株(C株)に感染したときはこのような現象は見られない。
なにゆえこのような機構が備わっているかは不明だが、ウイルス感染に対して最も迅速に対応できるB細胞のみを動員することになるので、個体にとっては有利に働くのかもしれない。
となっています。
説明を読んで、よくわからなくても構いません。
「免疫刷り込み(≒ 抗原原罪)」のことをよくわかっている人はいません。誰もこの現象を「正確に」把握していないし、仕組みも解っていないようです。
わかっていない人々が「免疫刷り込み(≒ 抗原原罪)」の説明を書いているので、いろいろとわかりにくいのは当然のことです。
分かっていない物事について正確さを追求すると泥沼にはまるので、ここでは「3-5.感染例」を読み解くのに便利な考え方と割り切って、「免疫刷り込み(≒ 抗原原罪)」を説明します。
「3-5.感染例」は、コロナ COVID-19 に3回なり、2回目と3回目にそれぞれ「免疫刷り込み=(2)」が観察された症例です。
「3-5.感染例」で起こった「免疫刷り込み=(2)」を理解することは、mRNAワクチン等のメリット・デメリットを考えるうえでとても重要なので、この説明ページを置いています。
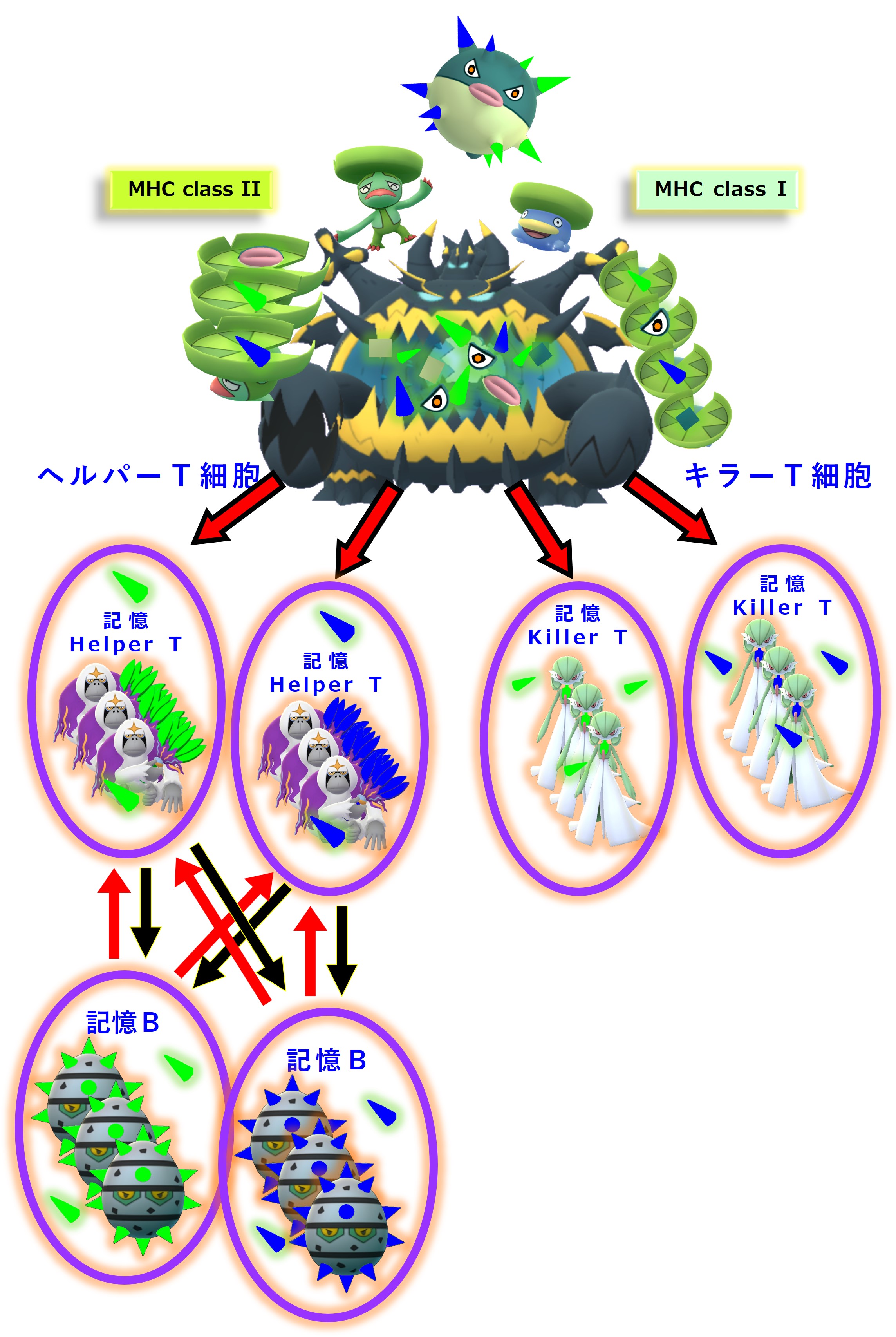
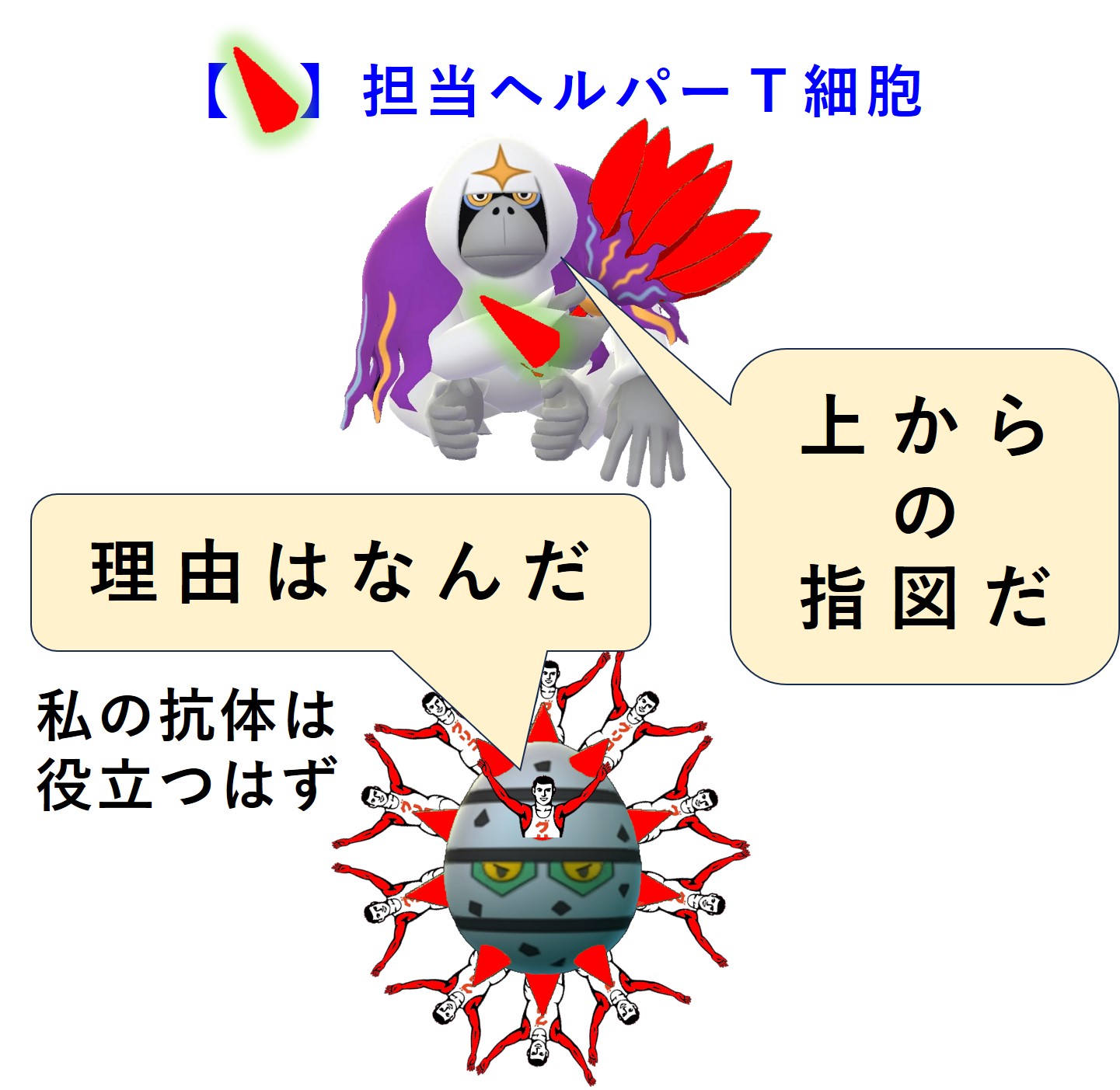
まず、「3-1-5.免疫的学習」の図を再掲します。
紫のリング3か所でメモリー細胞が作られます。
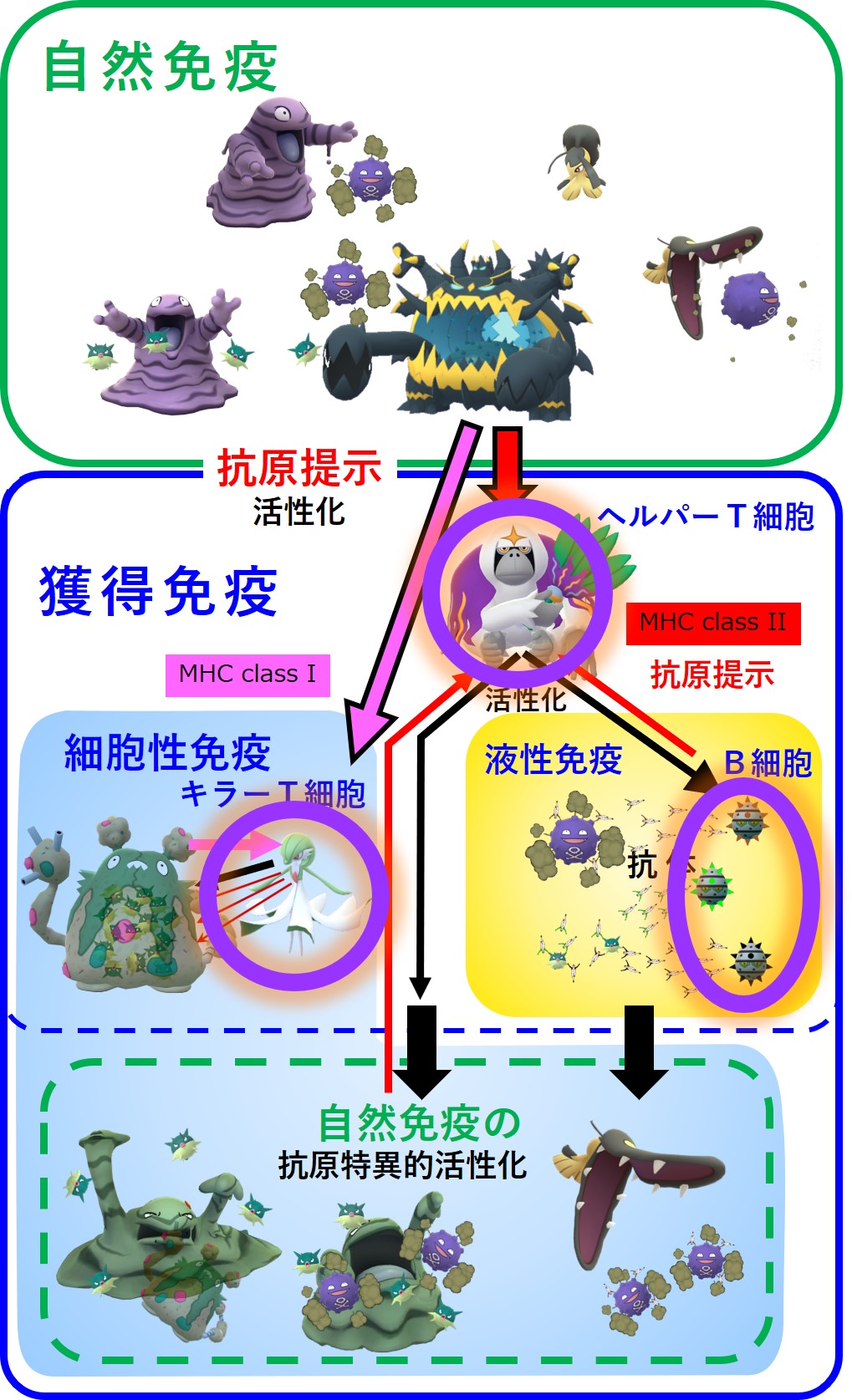
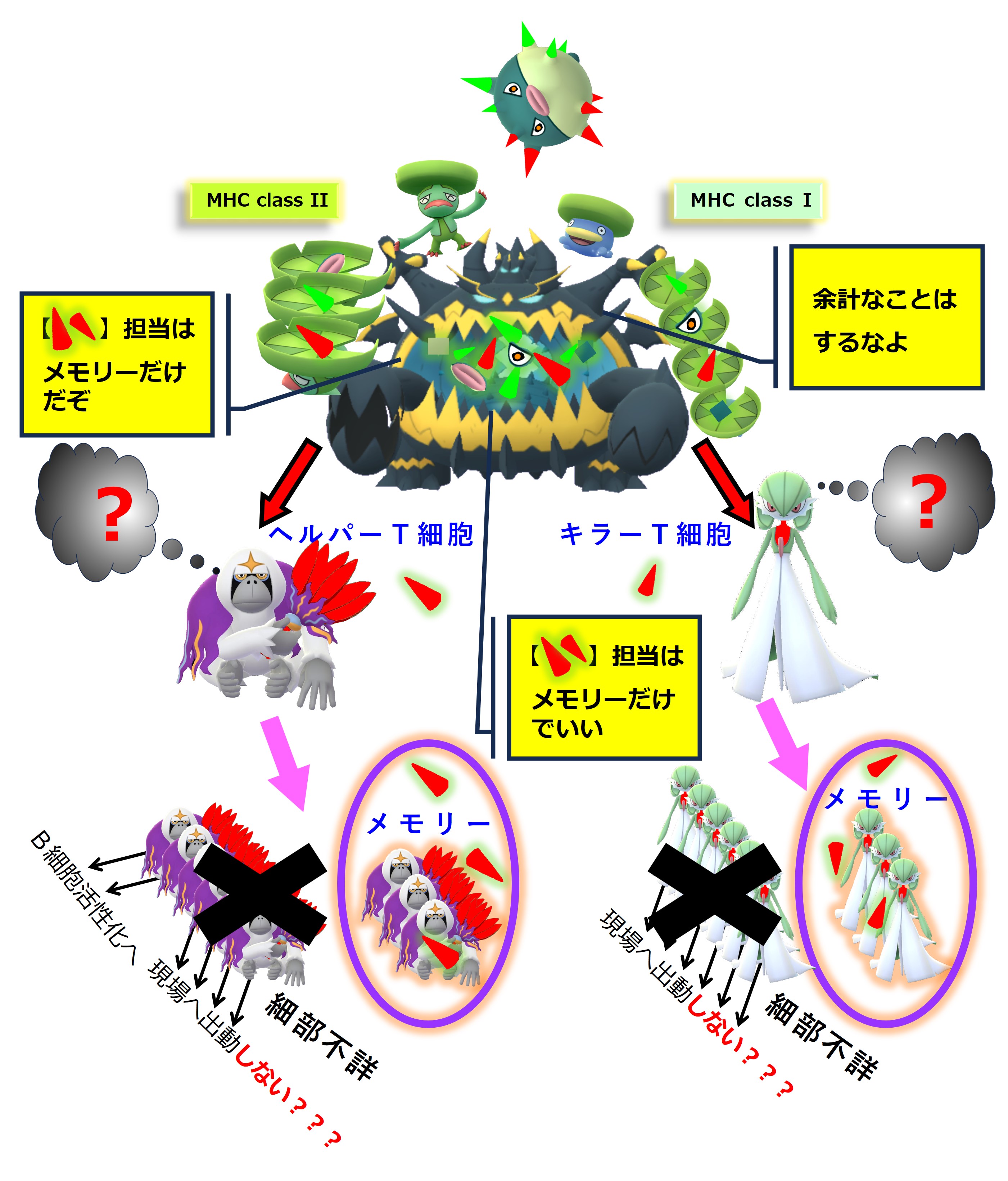
では、これから コロナウイルス初感染(A株) → 2回目の感染(B株) → 3回目の感染(C株) で何が起こるのか順番に見てみましょう。
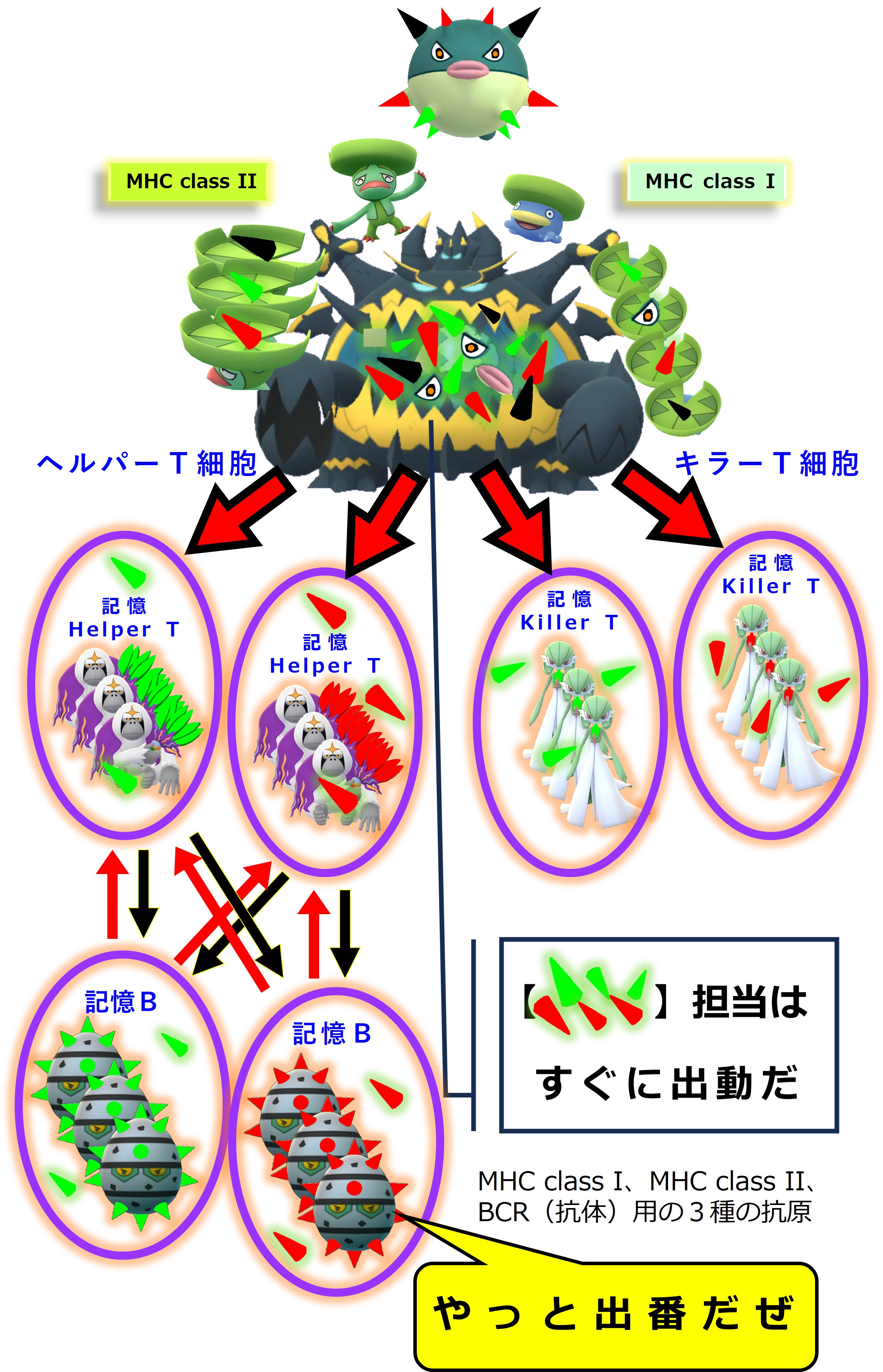
コロナウイルス(A株)に感染しました。コロナ初感染だったようです。自然免疫系に属する食細胞たちが粘膜下でコロナウイルス(A株)をガッパガッパと食べ始めます。

ウイルス(A株)を食べた樹状細胞は、この異物についての抗原情報を獲得免疫系と共有し、「異物が持つ固有抗原」用の免疫細胞(ヘルパーT細胞、キラーT細胞)を見つけて活性化するために、最寄りのリンパ節へ向かって移動します。

樹状細胞は食べたウイルス(A株)をバラバラに分解します。アミノ酸 10 ~ 30 個分の長さを持つペプチドは class II のMHCに載せてヘルパーT細胞に抗原提示します。アミノ酸 8 ~ 11 個分の長さを持つペプチドは class I のMHCに載せてキラーT細胞に抗原提示します。
ヘルパーT細胞とキラーT細胞はそれぞれのTCR(T細胞受容体)を使って自分の担当する「MHC+ペプチド抗原」を探します。
自分の担当する特定の「MHC+ペプチド抗原」を抗原提示している樹状細胞を見つけたヘルパーT細胞とキラーT細胞は、活性化します。増殖し、多くはリンパ節から出て血流に乗り、全身を巡回します。ヘルパーT細胞の一部はリンパ節内でB細胞のたくさんいるところへ向かいます。
増殖したヘルパーT細胞とキラーT細胞の一部はメモリー細胞化して休息にはいります。つまり次の感染に備えて眠ってしまいます。
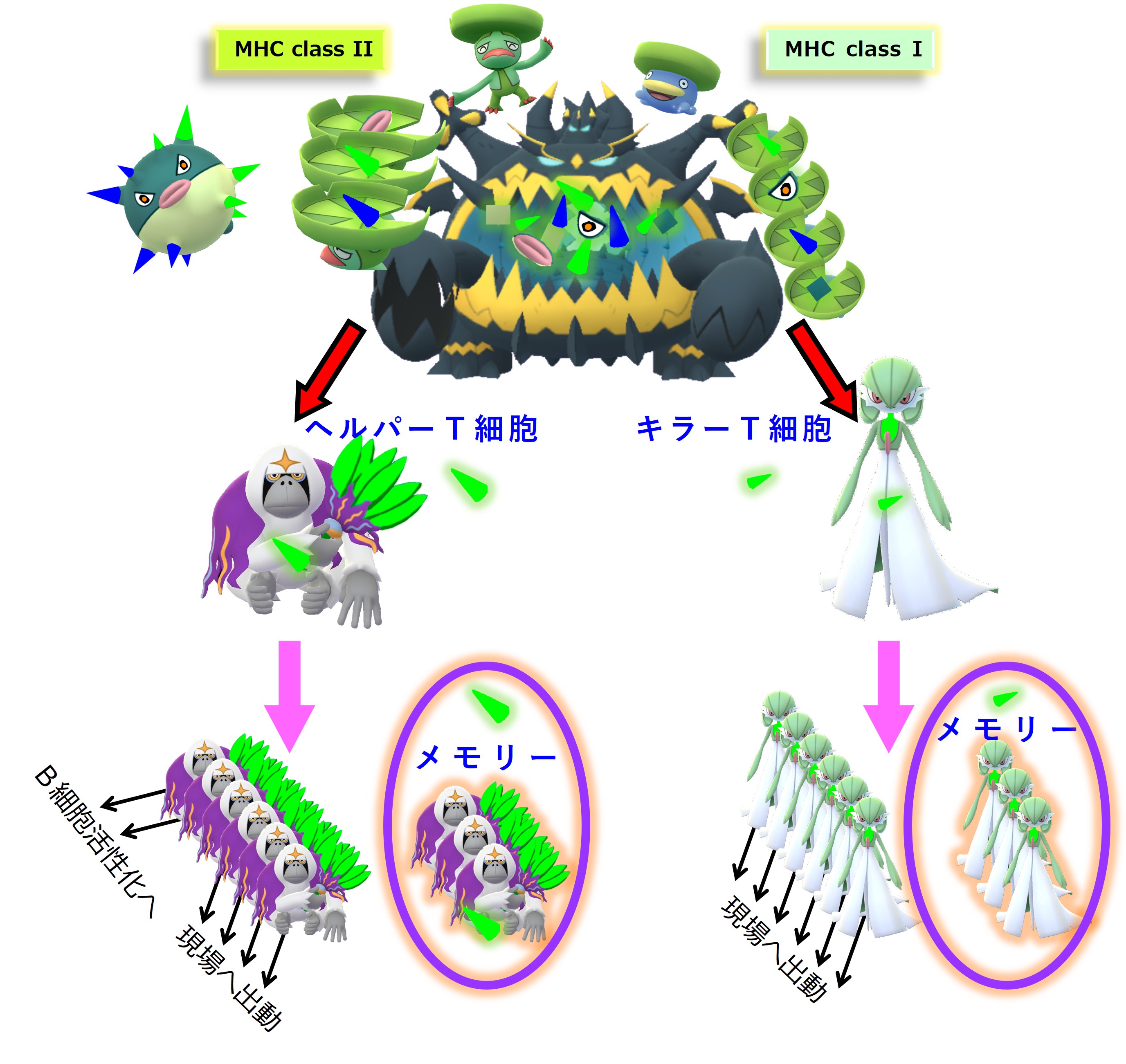
コロナウイルス(A株)のあらゆる固有ペプチド抗原に対応するヘルパーT細胞とキラーT細胞のメモリー細胞が作られ、次の感染に備えて眠ります。
一部のヘルパーT細胞はリンパ節内でB細胞の活性化に向かいます。
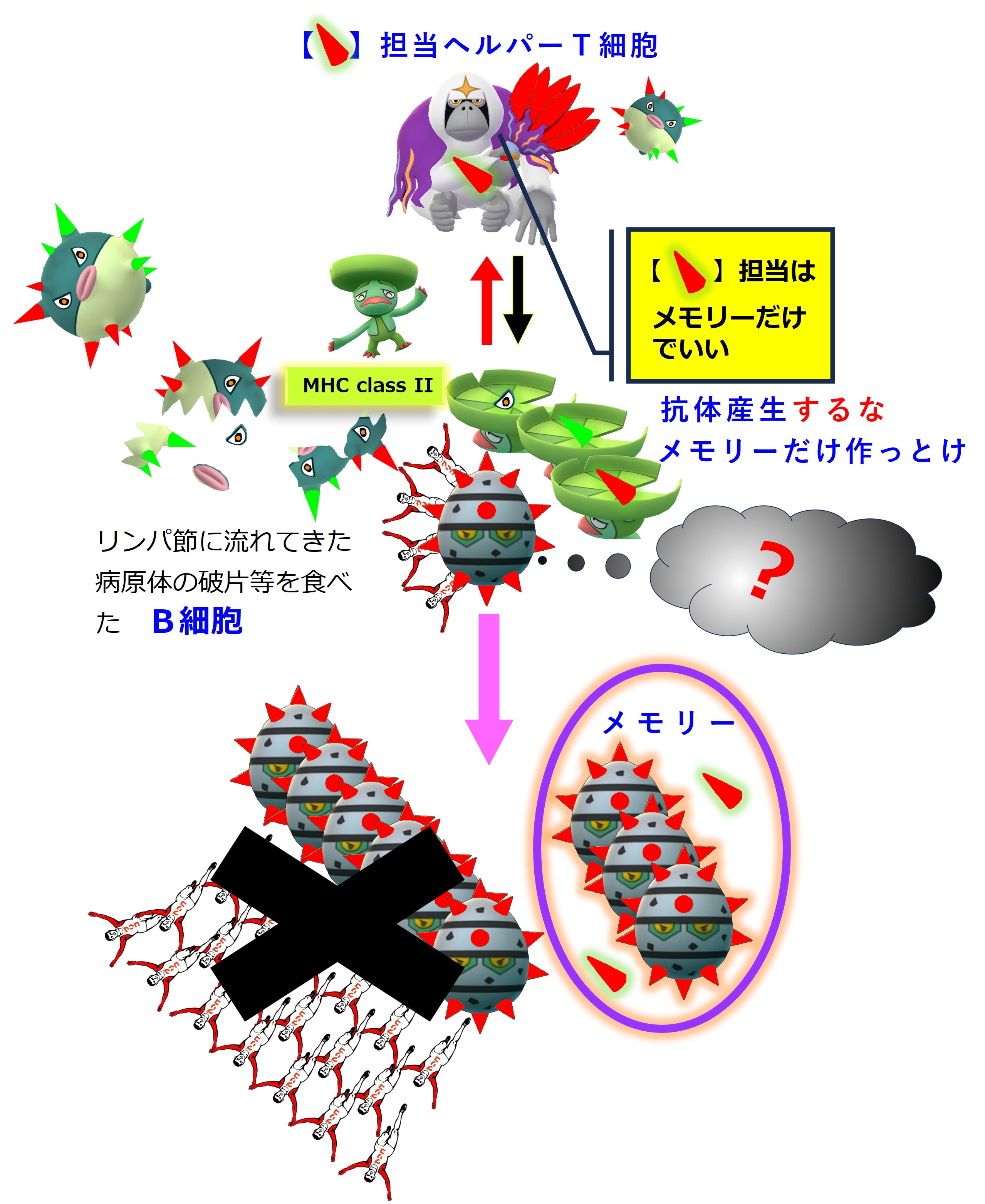
リンパ節には炎症の場からウイルスやウイルスの死骸・破片が流れてきます。リンパ節にいる幼若なB細胞たちは、細胞表面のB細胞受容体(抗体)にそうしたウイルス破片が結合すると、その破片を食べてバラバラに分解します。そしてB細胞の表面に「MHC class II + ペプチド抗原」を提示します。
ヘルパーT細胞はTCR(T細胞受容体)を使って、B細胞表面の「MHC class II + ペプチド抗原」を調べまくり、自分の担当する「MHC+ペプチド抗原」を見つけたならば、それを提示しているB細胞を活性化します。
活性化したB細胞は増殖し、抗体を多量に産生します。一部はメモリー細胞化し、次の感染に備えて眠ります。
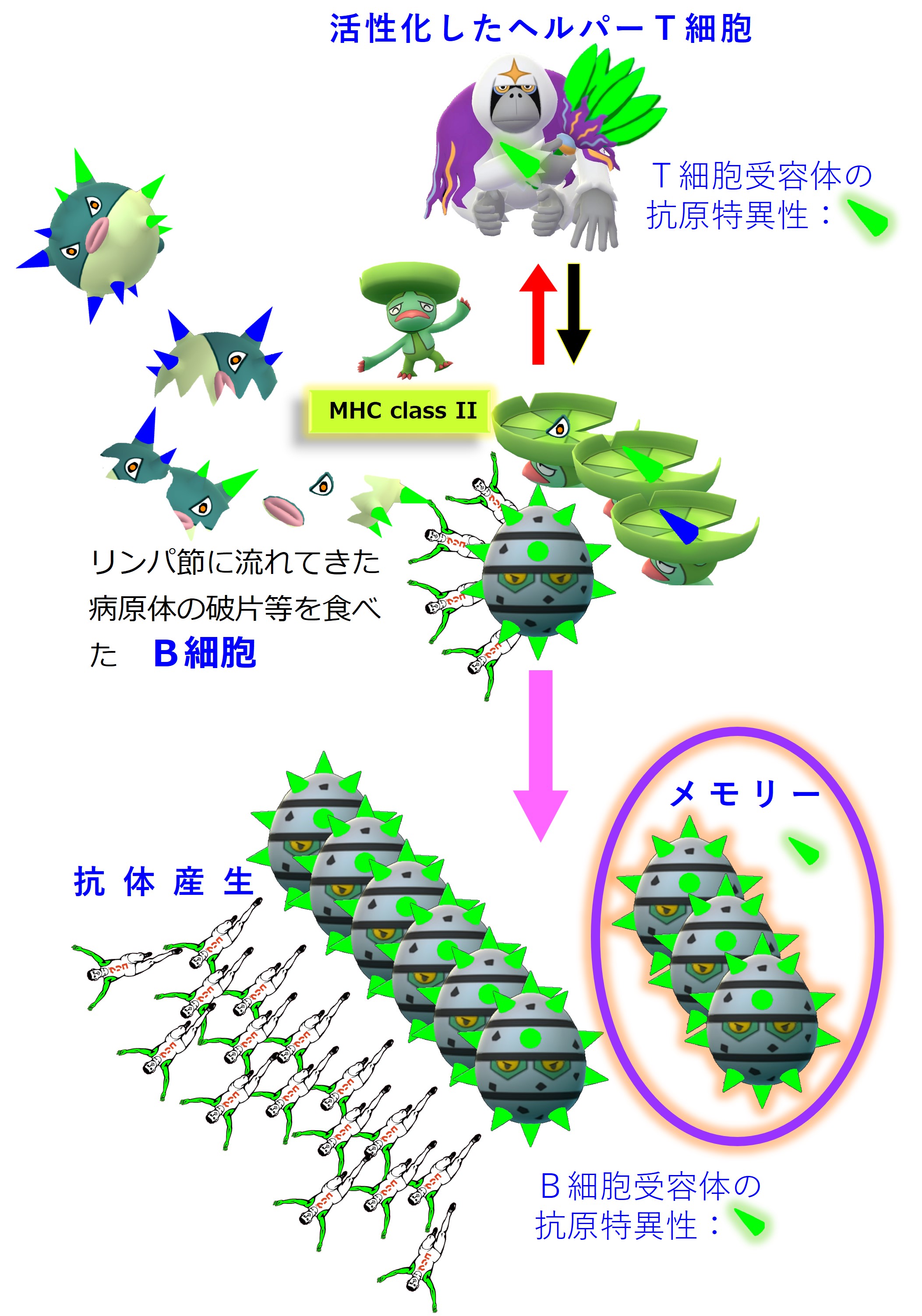
ヘルパーT細胞は、「MHC+ペプチド抗原」を見ています。B細胞受容体(抗体)がどのようなエピトープと結合しているのかには、まったく無関心です。
B細胞は、ウイルス粒子を構成するタンパクの中のエピトープを見ています。そして、エピトープを見つけるとB細胞受容体(抗体)が結合します。B細胞は異物を食べます。バラバラにします。バラバラにしたいろいろなペプチド抗原をMHCに載せてヘルパーT細胞に提示します。
繰り返しますが、ヘルパーT細胞は、B細胞の提示した「MHC+ペプチド抗原」だけを見ています。B細胞の抗体がどのようなエピトープと結合したかには無関心です。
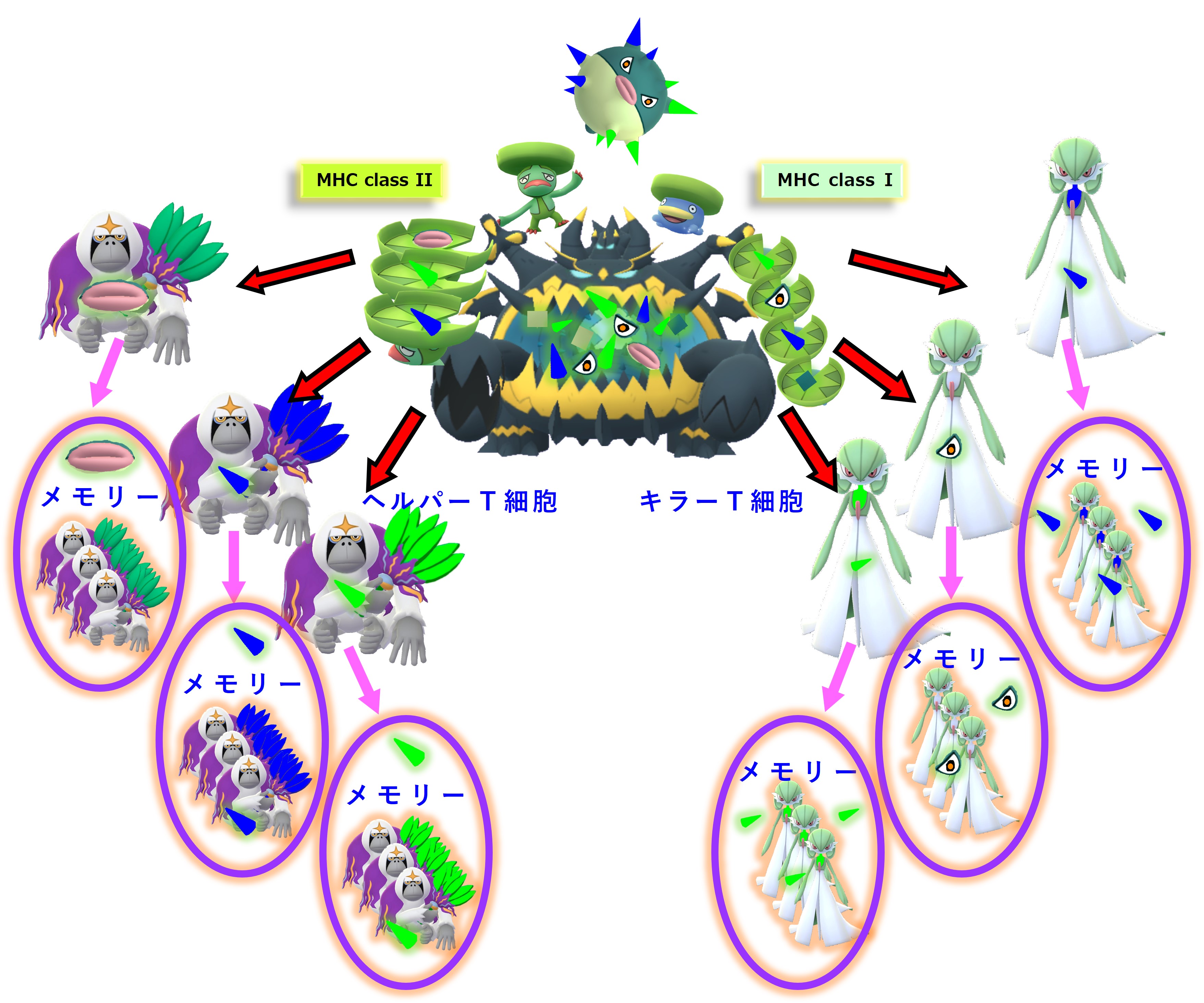
したがって、次図のようなことも起こります。
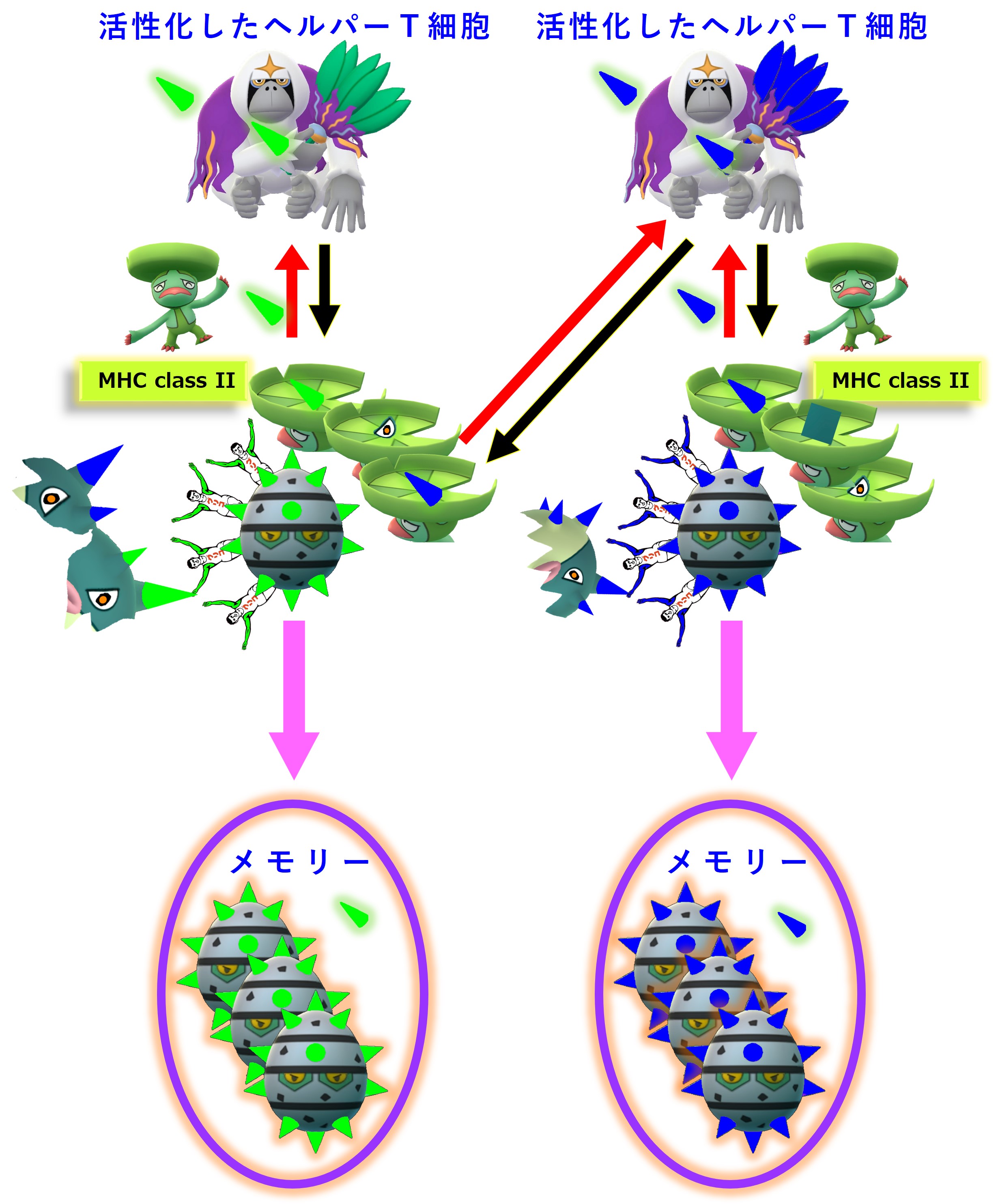
ヘルパーT細胞とB細胞とが「1:1」関係ではなく「多:多」関係であることにより、抗体産生までの免疫応答が速くなります。
初めてのコロナ感染(A株)が治った後も、次のようなメモリー細胞が残ります。
さて、1年後に、コロナウイルス(B株)に感染しました。コロナ2回目の感染です。
コロナウイルス(B株)を食べた樹状細胞がリンパ節に移動して情報提供やリンパ球の活性化を開始します。

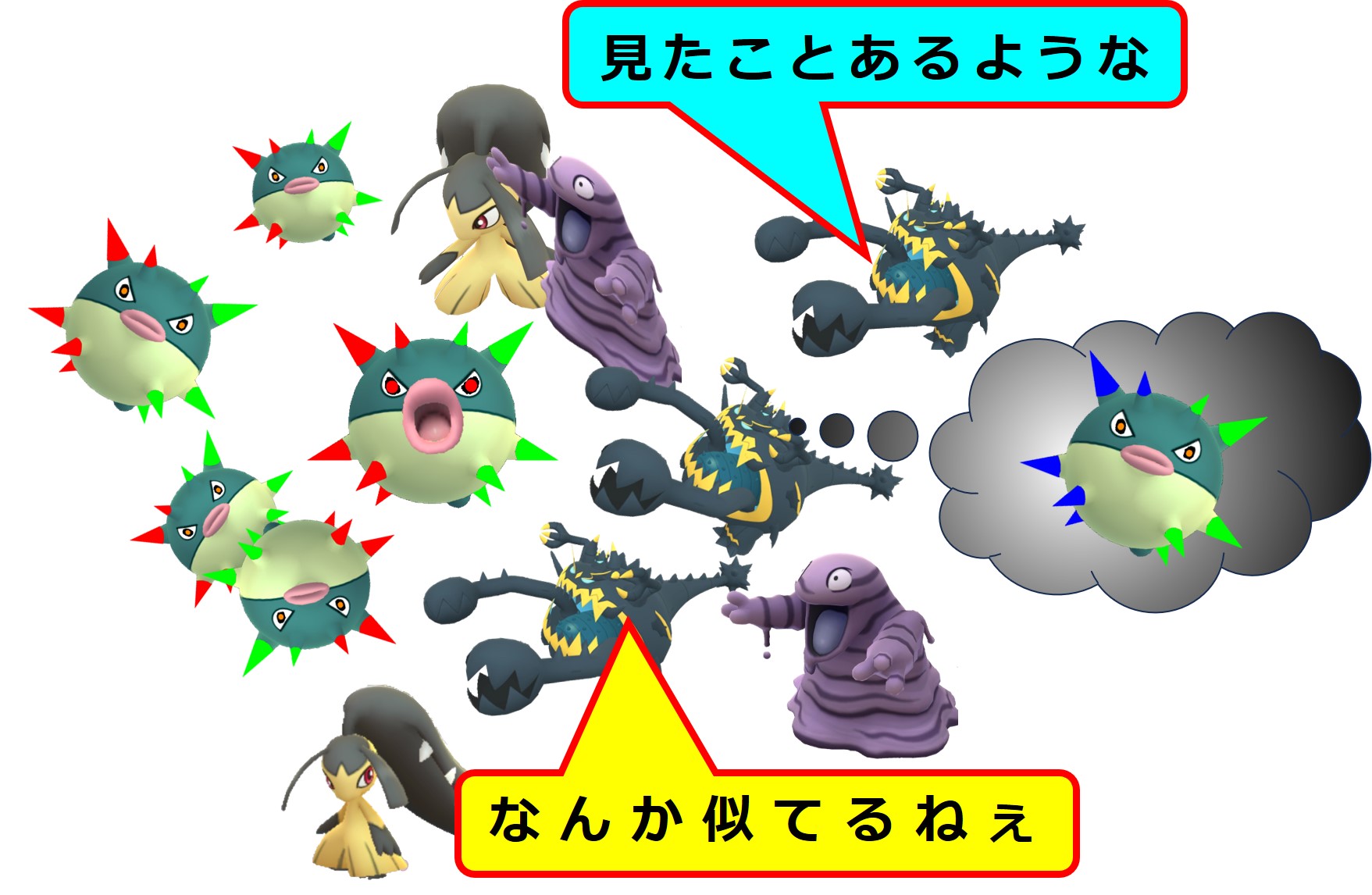
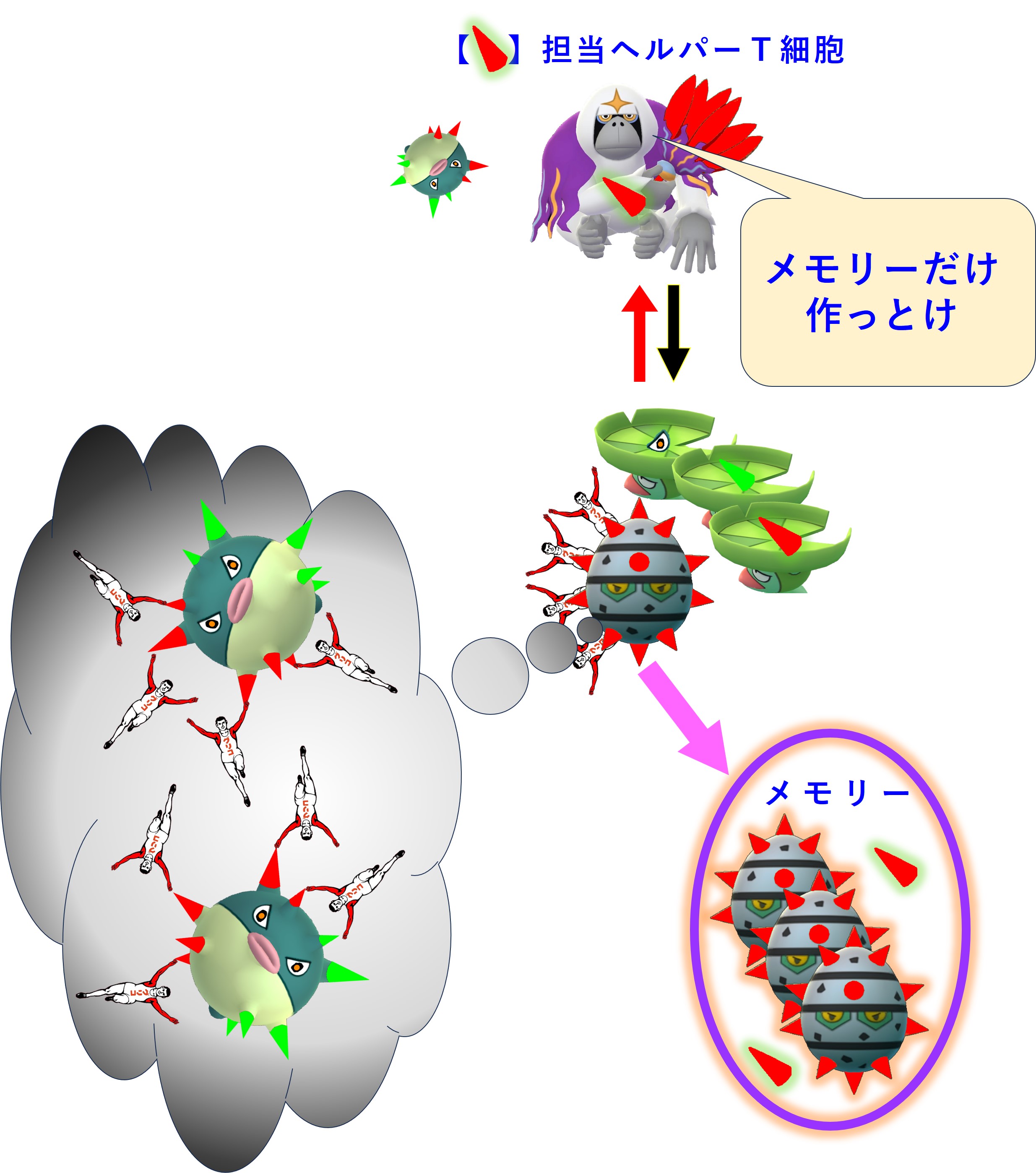
その際に免疫系は、1年前に感染したコロナウイルス(A株)と今回感染中のコロナウイルス(B株)とに「共通するエピトープ」に対する抗体を作る免疫細胞をすぐに活性化します。
眠っているメモリー細胞(記憶B細胞)を叩き起こします。
したがって細胞性免疫でも、A株とB株とで共通する「MHC+ペプチド抗原」を認識するメモリー細胞(記憶T細胞)は、すぐに活性化していると考えられます。
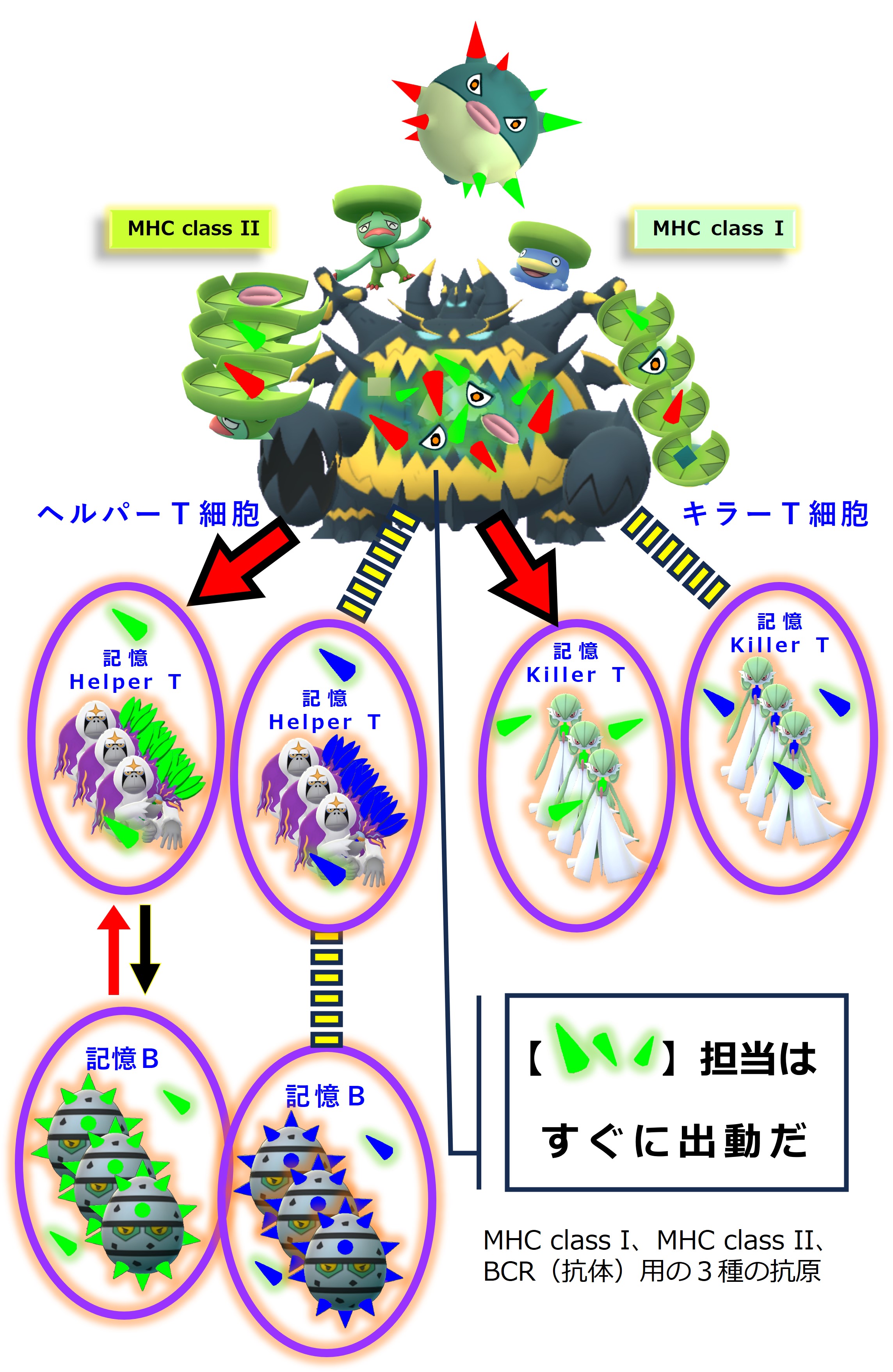
それに対して、A株には無く、B株で新しく出会った「MHC+ペプチド抗原」や「エピトープ」に対しては、メモリー細胞を作るところまでは反応が進むようですが、現場出動や抗体産生は起こりません。
詳しい仕組みは不明です。
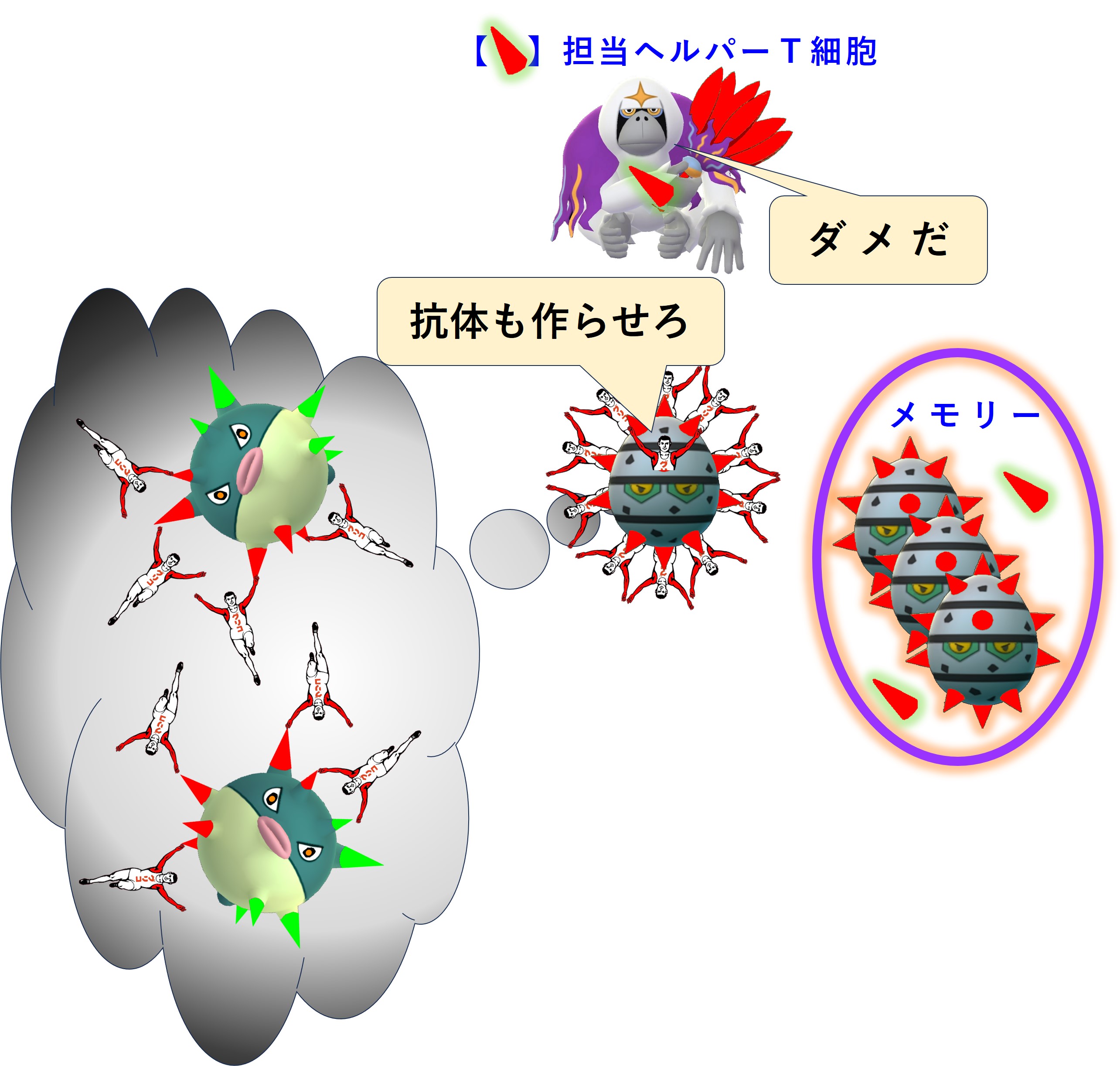
コロナウイルス(B株)で出会った新しいエピトープに対する抗体を多量に生産すれば、感染症の治りは速まるはずです。
しかし、新しいエピトープに対しては担当するメモリー細胞を作るだけで、抗体の生産はおこないません。
これが「免疫刷り込み(≒ 抗原原罪)」と呼ばれる現象です。


「免疫刷り込み」のメリットとしては、「新しいエピトープを新抗体で攻撃しなければ、エピトープの免疫回避変異を促進しない。将来の流行株にそのエピトープが残っていた場合、迅速に抗体を産生してウイルス感染を抑止できる」ことが考えられます。
また感染症は、「初期の自然免疫」および「過去の感染との共通抗原に対して迅速に立ち上がった獲得免疫」だけでほぼ免疫側が勝ち、収束に向かうことが多く、「新しい抗原に対する獲得免疫」が遅れて立ち上がるころにはもう勝負がついているのであまり役に立たない、といったことも関係しているかもしれません。
さて、1年後に、コロナウイルス(C株)に感染しました。コロナ3回目の感染です。
2回目の感染と同じような応答となります。
自然免疫と、過去の感染で用意された獲得免疫メモリー細胞が頑張ります。
新しいエピトープ、ペプチド抗原に対してはメモリー細胞を作るだけです。


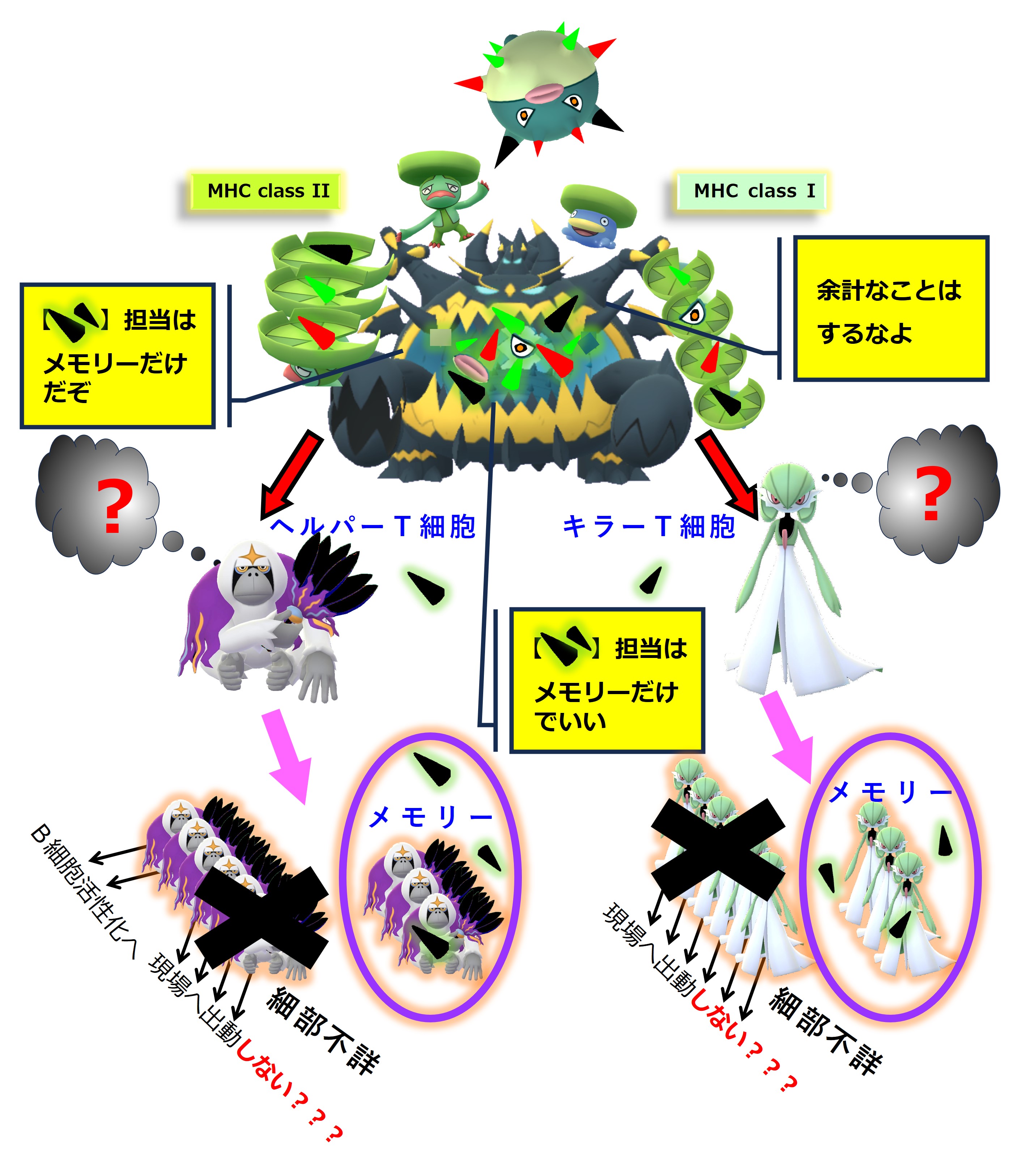
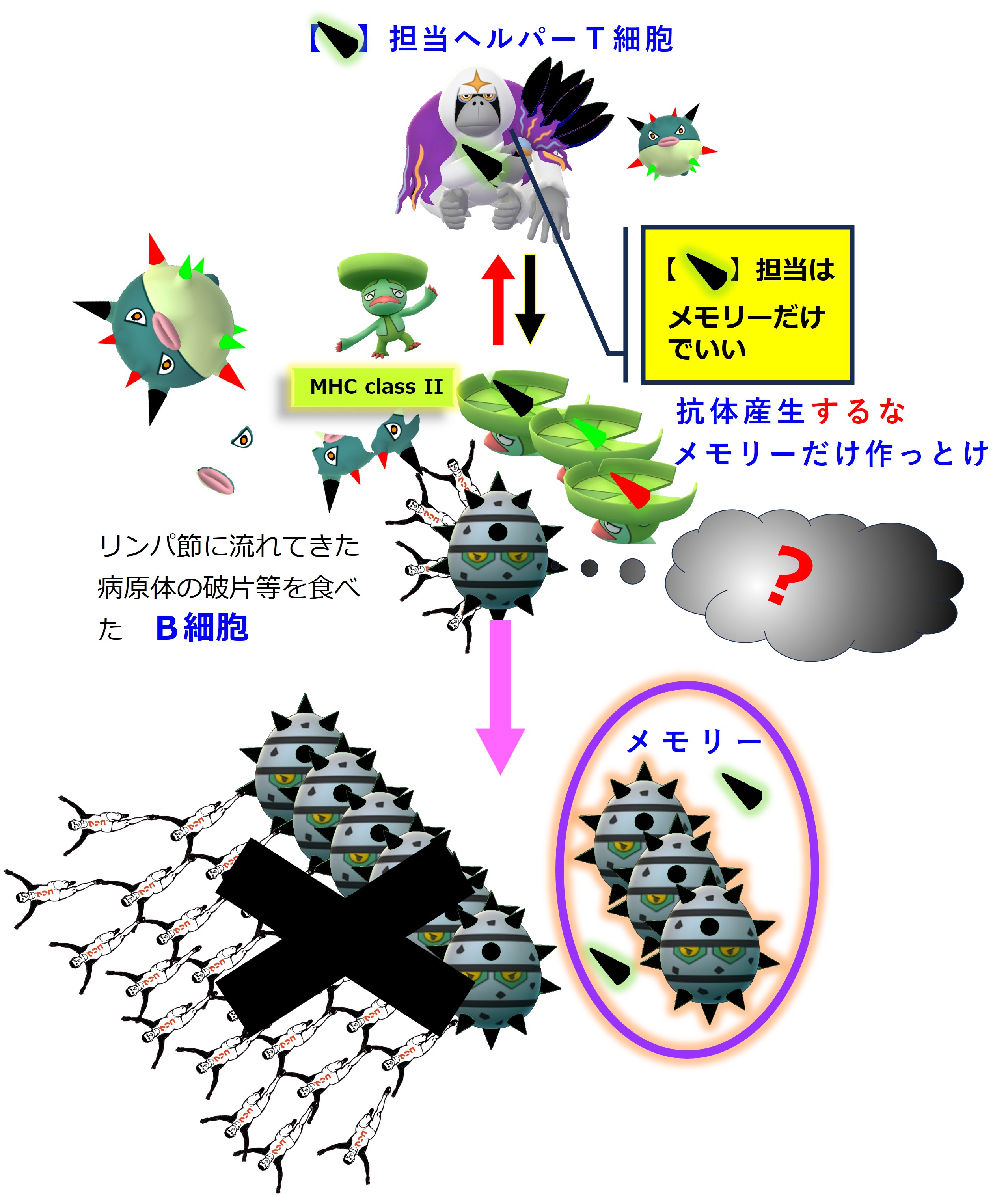
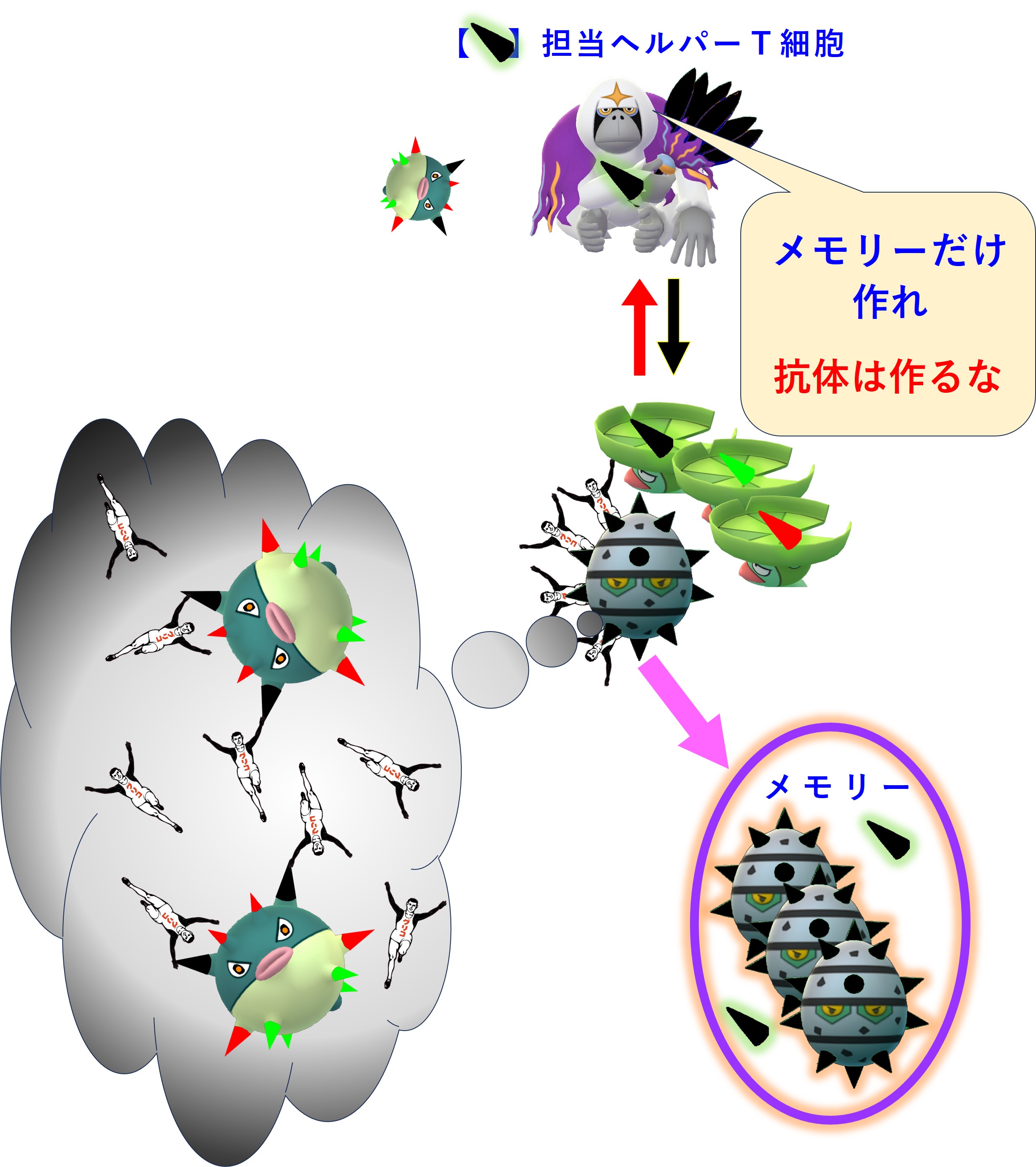

以上、「免疫刷り込み(≒ 抗原原罪)」の免疫系全体の仕組みについての図説(詳細不明)となります。
では、抗体産生に着目して「免疫刷り込み(≒ 抗原原罪)」という現象を見てみましょう。
液性免疫(抗体産生)におこる免疫刷り込みについて説明します。
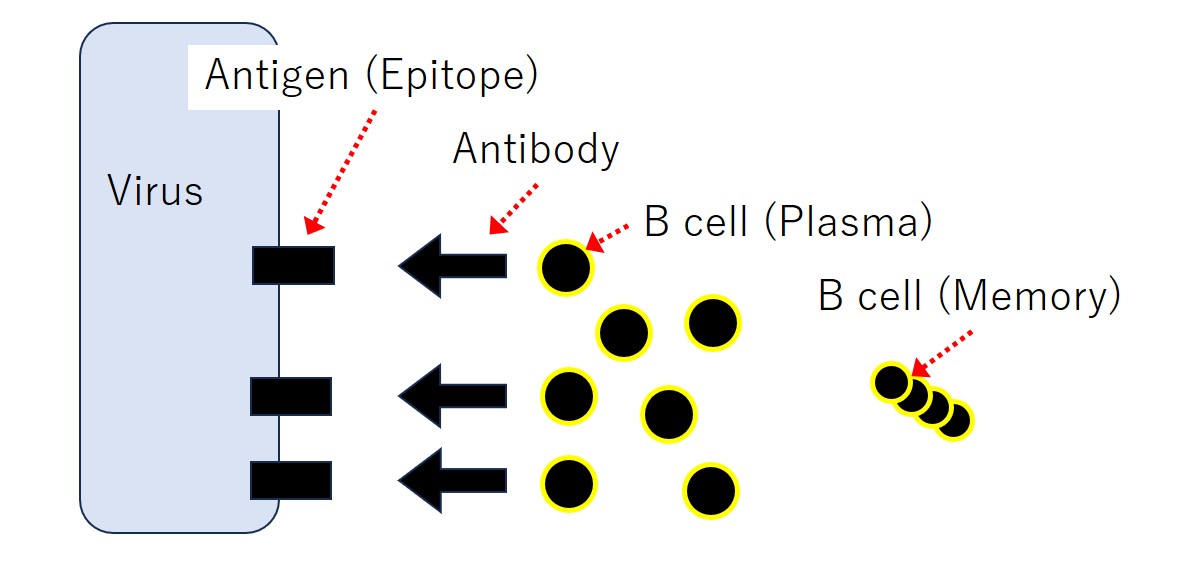
ウイルスなど病原体の表面には 抗原(Antigen) があります。抗原とは 抗体(Antibody) が結合する物質(異物;敵;非自己)のことです。抗体は リンパ球(B細胞) が産生します。
コロナに罹った人やコロナのワクチン接種を受けた人のリンパ球はコロナウイルス(のスパイク)に結合する抗体を産生します。
コロナウイルスのスパイクタンパクは大きな抗原ですが、抗体はスパイクのどこにでも結合するわけではありません。抗体の強く結合する部分が10か所とか20か所とかあります(注:数は適当に言っています)。
抗体の強く結合する部分は、たいてい5個~8個くらいのアミノ酸が連なったペプチド(小さなタンパク)です。それは抗原の最小基本単位のような部分であり、エピトープ(Epitope) と呼ばれています。
基本的に、1種類のエピトープには1種類の抗体が対応し、1個のリンパ球(B細胞)は1種類の抗体のみを産生します。
本来、ヒトの免疫系はスパイクのあらゆる部分に結合できるようにあらゆる種類の抗体を産生する能力を持っているのですが、自分の身体がもともと持っているタンパクと同じ(5個~8個の)アミノ酸配列(自己抗原)に結合する抗体(自己抗体)は多量に産生しないように制御されています。
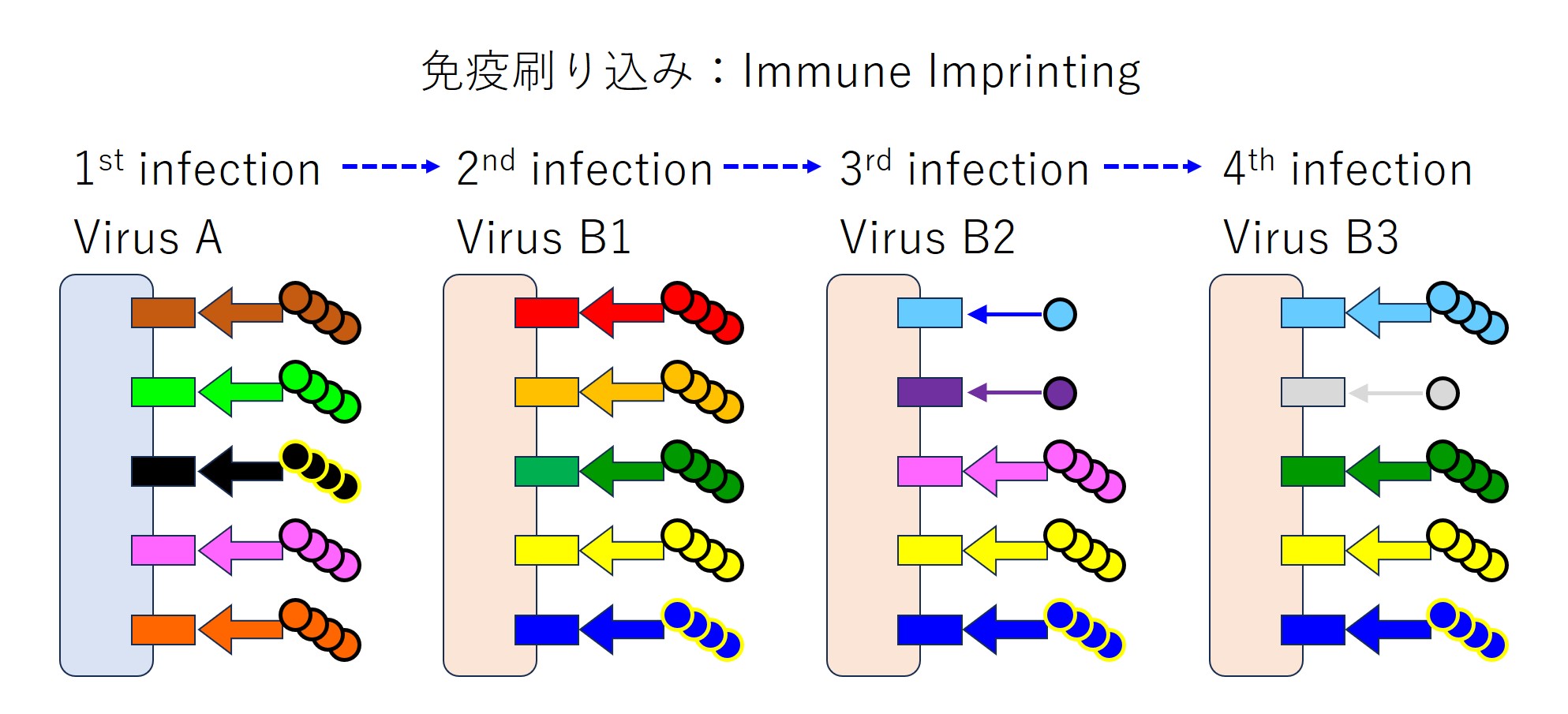
さて、ここでは「ウイルス A」に感染後、「ウイルス B1」、「ウイルス B2」、「ウイルス B3」という順に感染したときに抗体産生がどうなるかを見てみましょう。「A と B」は少し遠い関係のウイルスであり、「B1 ~ B3」は近い関係の変異種とします。
次図では、エピトープ(抗原)の種類を色で区別しています。
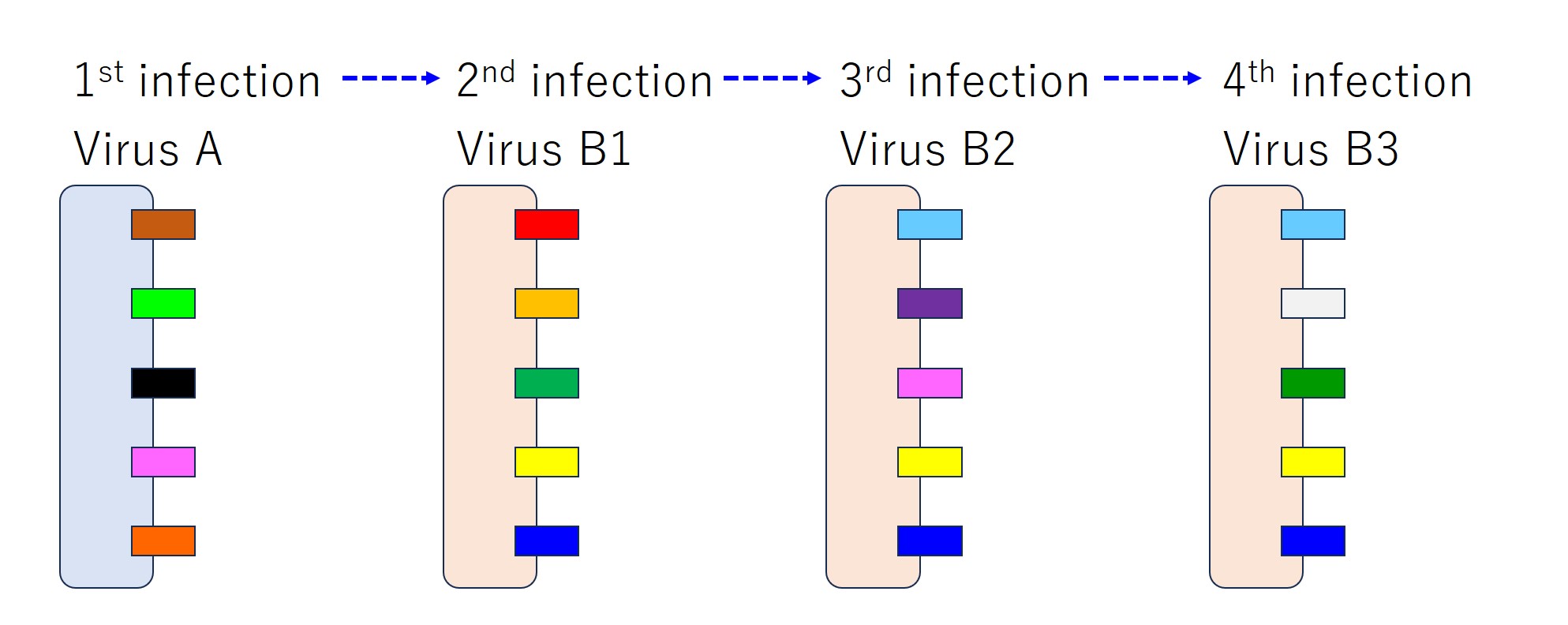
もし仮に、感染が起こるたびに毎回ウイルスの持つすべてのエピトープに対して抗体が産生されると、次図のようになります。
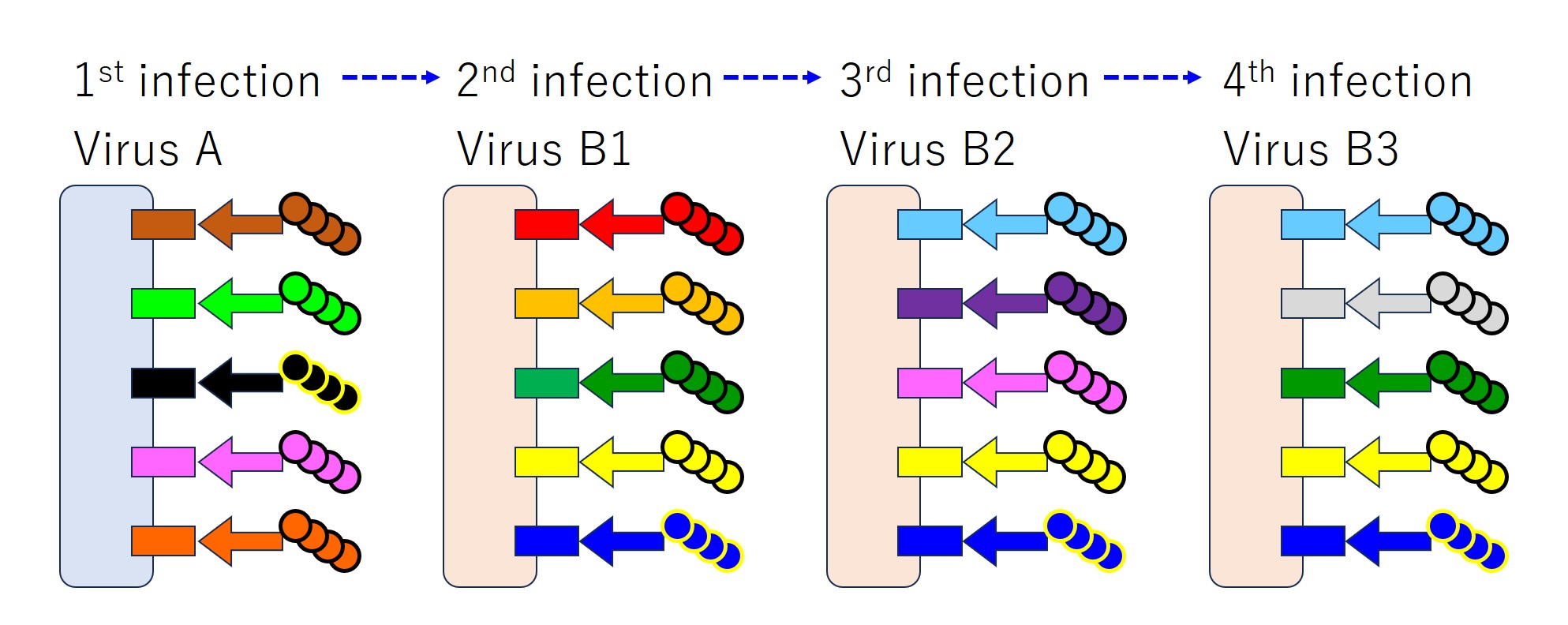
毎回、感染で産生される抗体がしっかりと全エピトープに結合して、ウイルスの感染力を弱めます(中和します)。
ところが実際には、(コロナウイルスに対しては)免疫刷り込みがおこり次図のようになります。
上図を順に説明します。
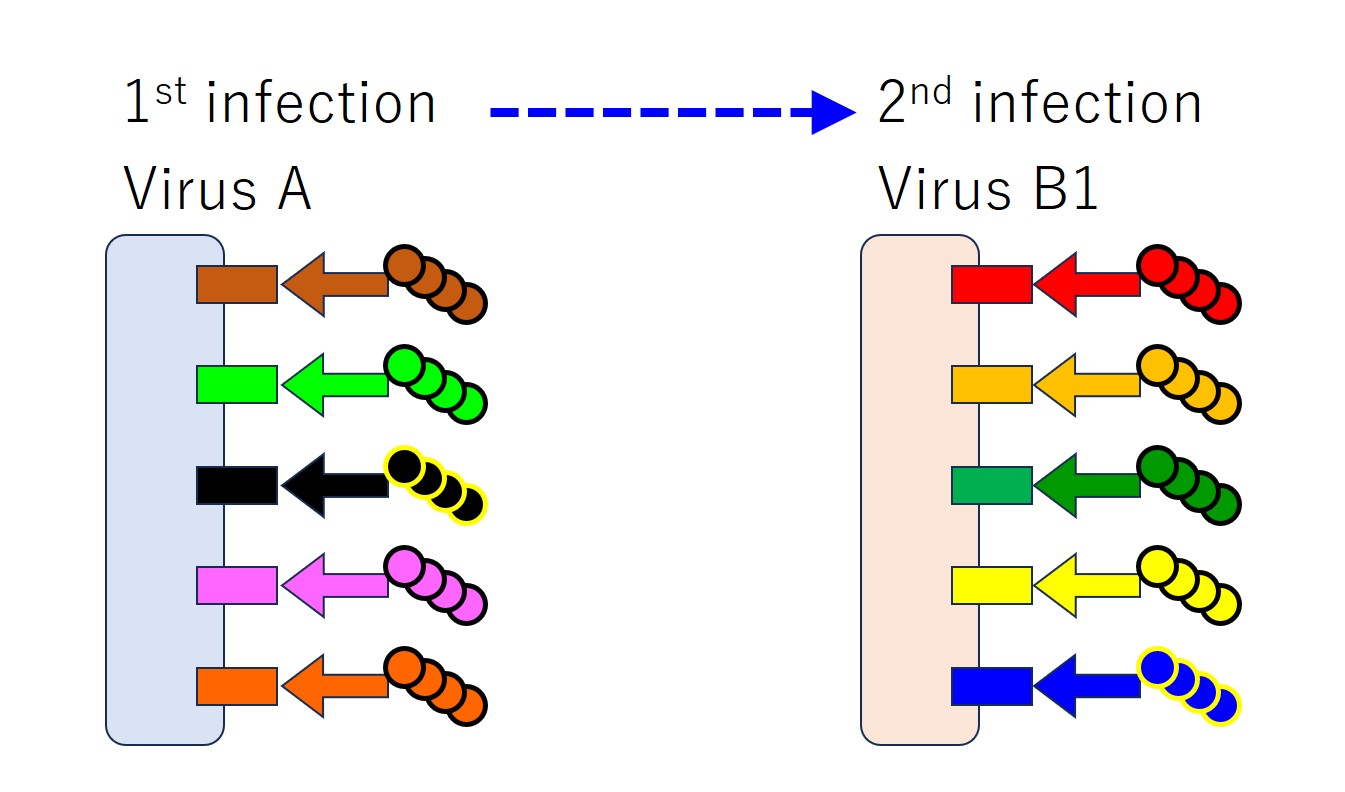
「ウイルス A」と「ウイルス B1」に「共通するエピトープ」が少ない場合、毎回すべてのエピトープに対する抗体が産生されます・・・(共通の度合いがどの程度であれば全エピトープに反応するのか私は知りません)。
感染症の治った後も、それぞれの抗体を担当するリンパ球(B細胞)が 記憶細胞(メモリー細胞)として残り続けます。
次に同じウイルスに感染したときは、残っていた記憶細胞がすぐに増殖して有効な抗体を大量に産生し、ウイルスの感染進行を抑えます。同じウイルスの再感染に対して「免疫」されるわけです。
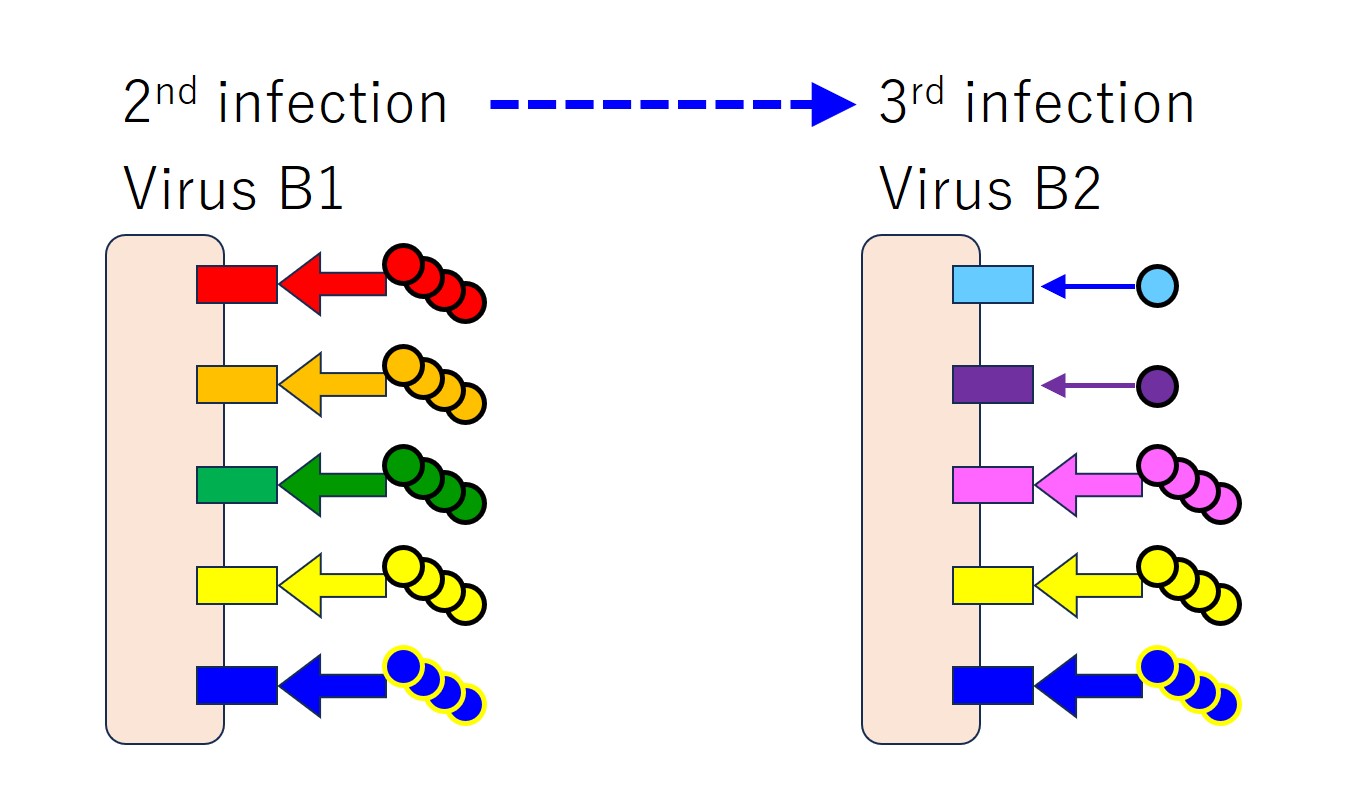
似たようなウイルス(つまり変異種)に続けて感染すると、免疫刷り込みがおこります。
先行感染のウイルス(B1 と A)と後行感染のウイルス(変異した B2)との共通エピトープに対する抗体のみをたくさん産生します。
先行感染のウイルスには無く、後行感染のウイルス固有のエピトープに対する抗体も中和抗体として役立つはずなのですが、少ししか産生しないのです。
免疫刷り込みは、人間社会における「前例主義(先例主義、事なかれ主義、お役所仕事・・・)」に似ています。
ほぼ同じ変異ウイルスに再度感染したとき、免疫系は「どうせ似たようなウイルスだろ。こちらの抗原は以前に抗体を作ったことがあるね。図面(鋳型)はあるからすぐに抗体を作るよ。大量生産するよ。でも、あちらはダメだな。過去に例がないよ。あんな新しい抗原に対する抗体は作ったことがない。だから今回は抗体を作らないよ。申し訳ないね。」とばかりに、過去に未体験のエピトープに対する抗体産生をサボるのです。しかし、また同じ注文を受ける可能性に備えて図面だけは用意し、また少し試作もするようです・・・免疫刷り込みの場合は・・・しかし、その図面さえ作らないのが抗原原罪(・・・あとで説明します)。
その結果、後行感染のウイルスに結合して感染力を弱める働きは小さくなりますから(ウイルス中和能力は低下しますから)、[液性免疫の比重の大きい感染症の場合は]先行感染時よりも重症化する恐れがあります。しかしコロナのように細胞性免疫の比重が大きい感染症では、重大な影響はないようです。
また、実際に抗体を産生したリンパ球の一部が記憶細胞に変化して残るわけではなく、感染の初期段階で最初から記憶細胞として増えるようです。
つまり、実際には抗体を大量に産生しない場合も記憶細胞は作られているようです(図面だけは作って将来の注文に備えるようです)。
こういう話が、実験等で確認されているのか、仮説にすぎないのか、私は免疫学者ではないので知りません。免疫学では、準定説化した仮説がいつのまにか反証されて消えていくといったことの起こることが珍しくありません。
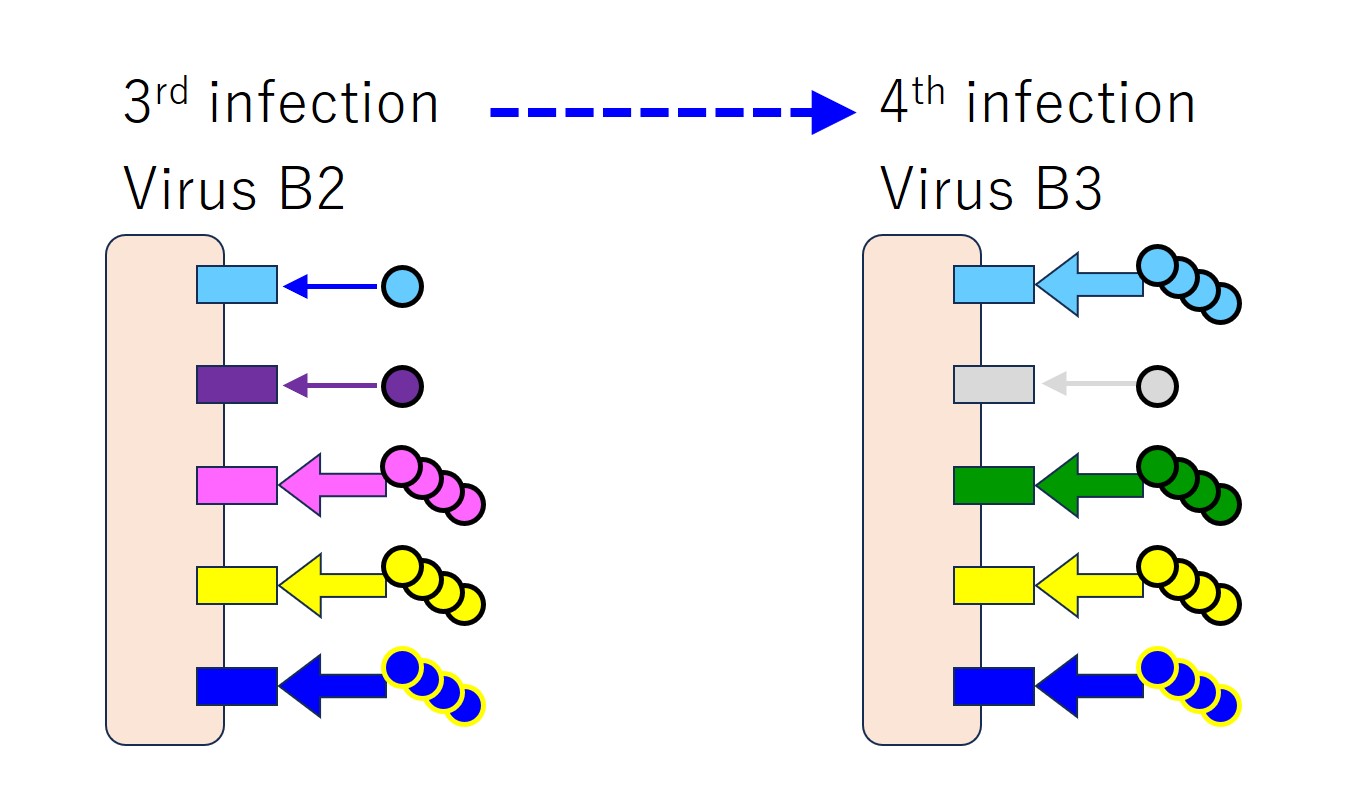
再度、同じウイルス(変異した B3)に感染すると、また先行感染ウイルス(B2、B1、A)との共通エピトープに対する抗体のみをたくさん産生します。
4回の感染を連ねると下図になります(マチガイがあるかもしれません)。

以上が、免疫刷り込みの概略説明です(詳しいことは私も知りません)。
何年先までの先行感染が免疫刷り込みとして影響を及ぼすのか、そういったことはウイルスによって異なるかもしれません。
最初の感染時の免疫的学習が、その後の繰り返す同種ウイルスによる感染にずっと影響を与え続けるのが「抗原原罪(Original Antigenic Sin)」です。次図のようになります。
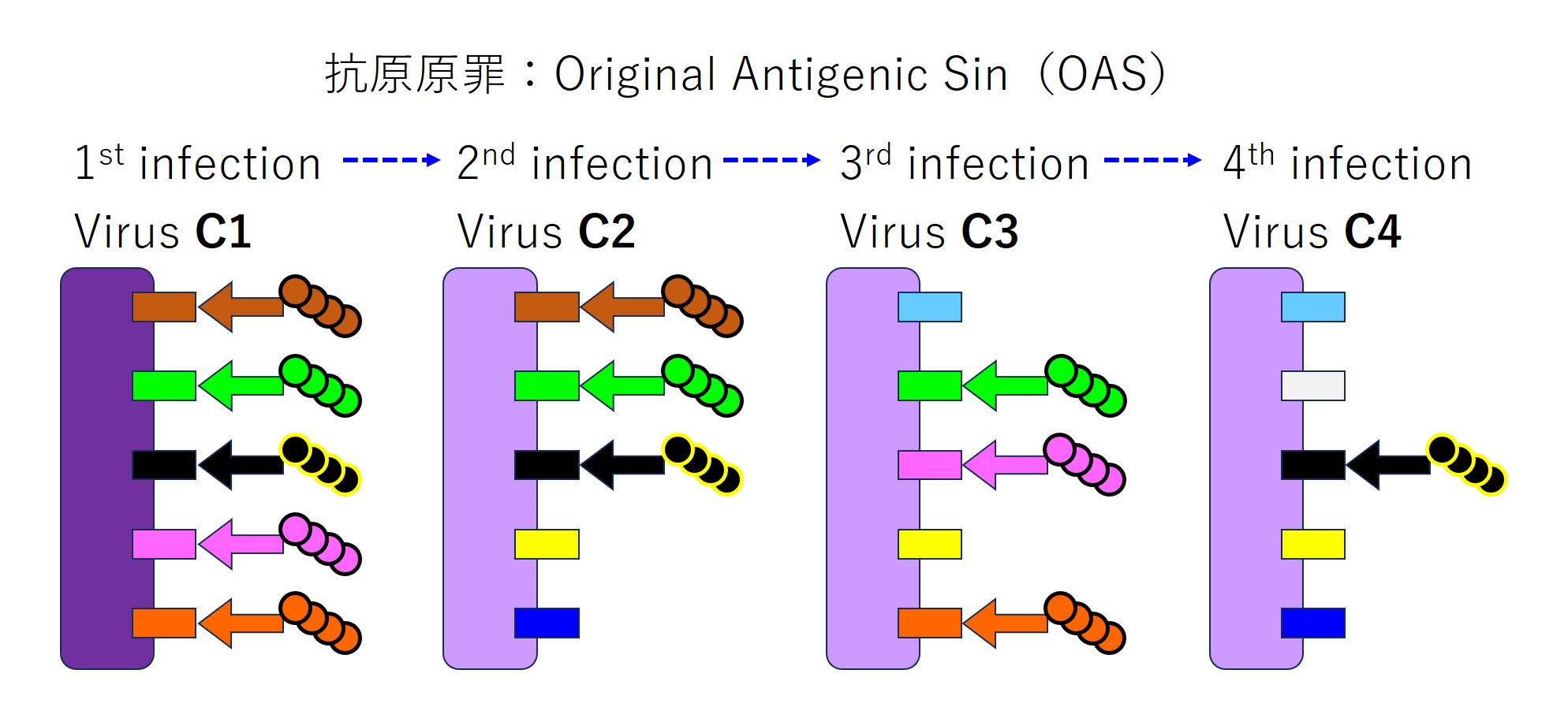
抗原原罪はかなり深刻です。新しいエピトープに対する抗体が産生されないだけでなく、記憶細胞も作られません。
しかし実際には、「免疫刷り込み」と「抗原原罪」の起こる仕組みの違いは解明されておらず、もしかすると両者の起こる基本的な仕組みはほとんど同じであって、単に起こることの程度の差にすぎない可能性もあります。
そのため、「免疫刷り込み」と「抗原原罪」とを同じ現象として扱っている人もいます。
このウェブページでは、便宜上の理由で、「免疫刷り込み」と「抗原原罪」の意味を区別します。
おそらく、免疫刷り込みは、感染するたびに毎回起こっていると考えられます。「A」の次に「B1」に感染した時は、免疫刷り込みの影響を受けるエピトープが少なすぎて、多くの種類の中和抗体がしっかりと産生されるため、免疫刷り込みが働いているのを見ることができないだけのことでしょう。
もっとスッキリとした簡明な説明が見たいという方向けの「手抜き説明」を紹介します。
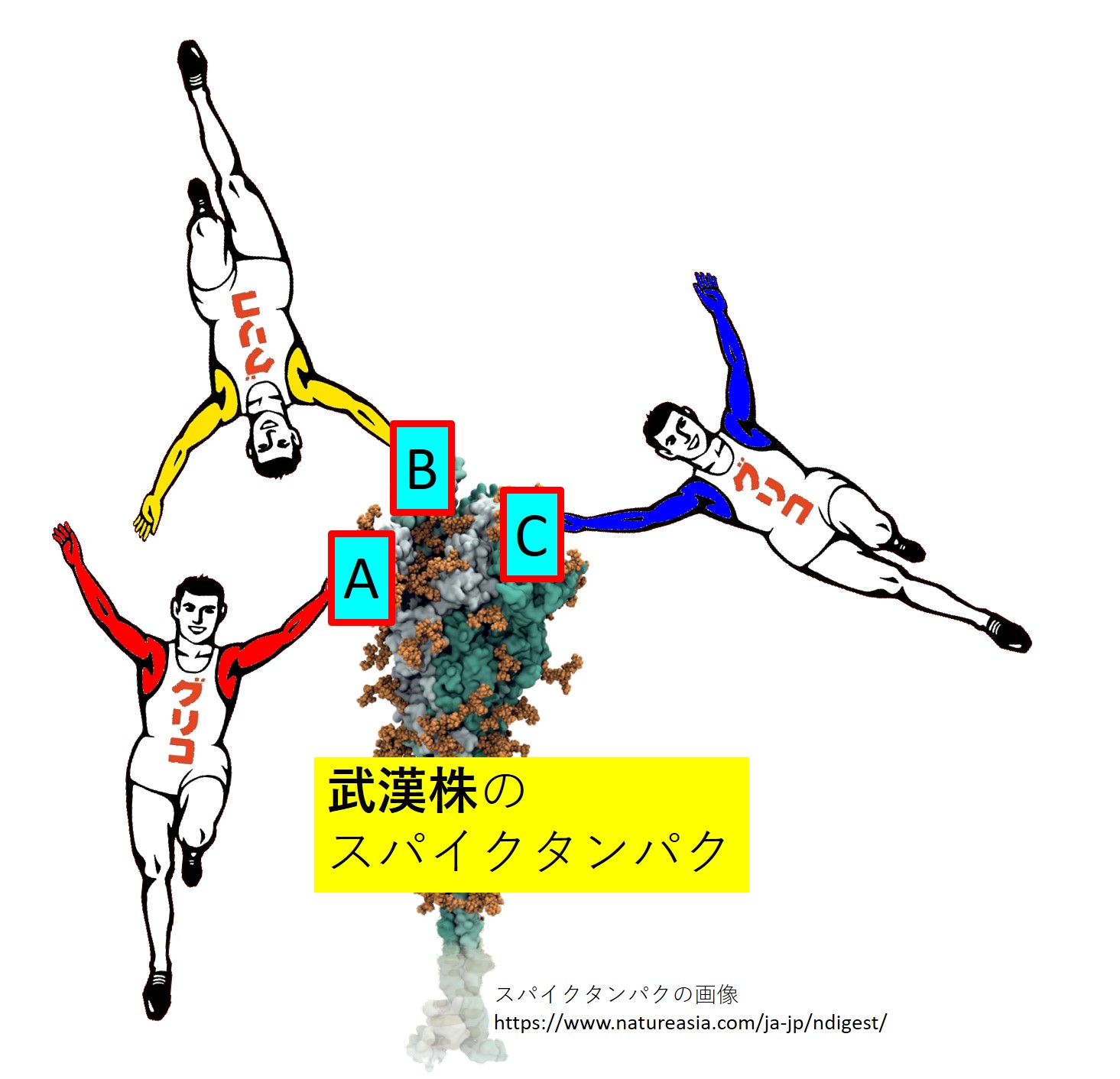
コロナウイルス(武漢株)のスパイクには3か所にエピトープ(A、B、C)があるとします。
武漢株の2年後に大流行の始まったオミクロン株(の初期流行型)のスパイクには4か所にエピトープ(A、B、D、E)があるとします。
両者で共通のエピトープは(A、B)です。

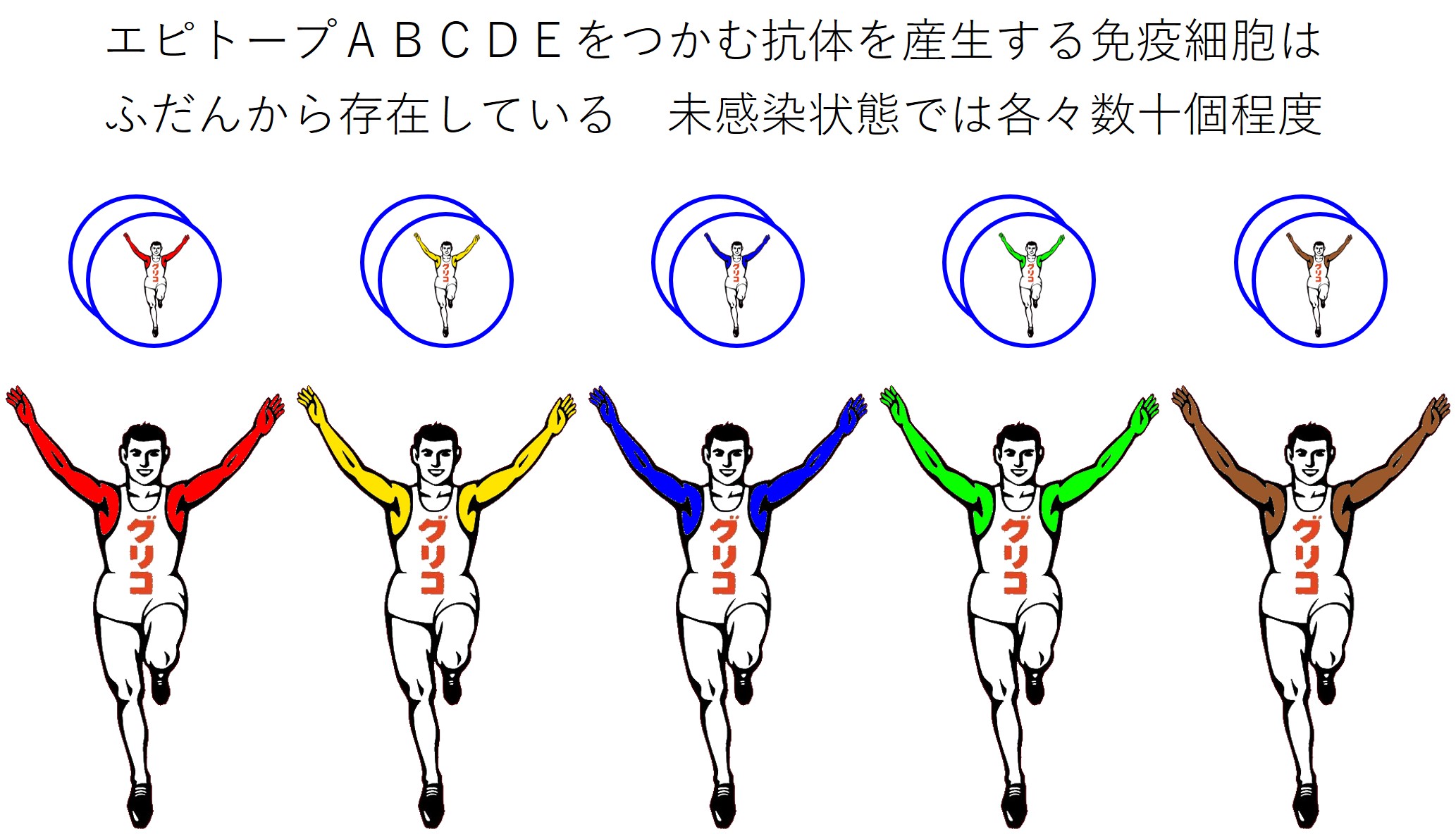
ヒトの免疫系は、いろいろなエピトープに対応する抗体を産生する免疫細胞を、ふだんから持っています(数十億~数百億種類に対応しているようです)。
コロナの感染経験がなくても、(今後出現するかもしれない変異株のものも含めて)コロナのあらゆるエピトープに対応する抗体を産生する免疫細胞を常に持っています。
抗体産生を担当するひとつの免疫細胞は、抗体1種類だけを作ります。
感染経験が無い病原体の抗原を認識する免疫細胞の数は少なく、同じ抗体を産生する免疫細胞は数十個を保持しているようです。
ヒトの免疫系は(数十億~数百億)✕(数十)個の抗体産生細胞をふだんから持っていることになります。
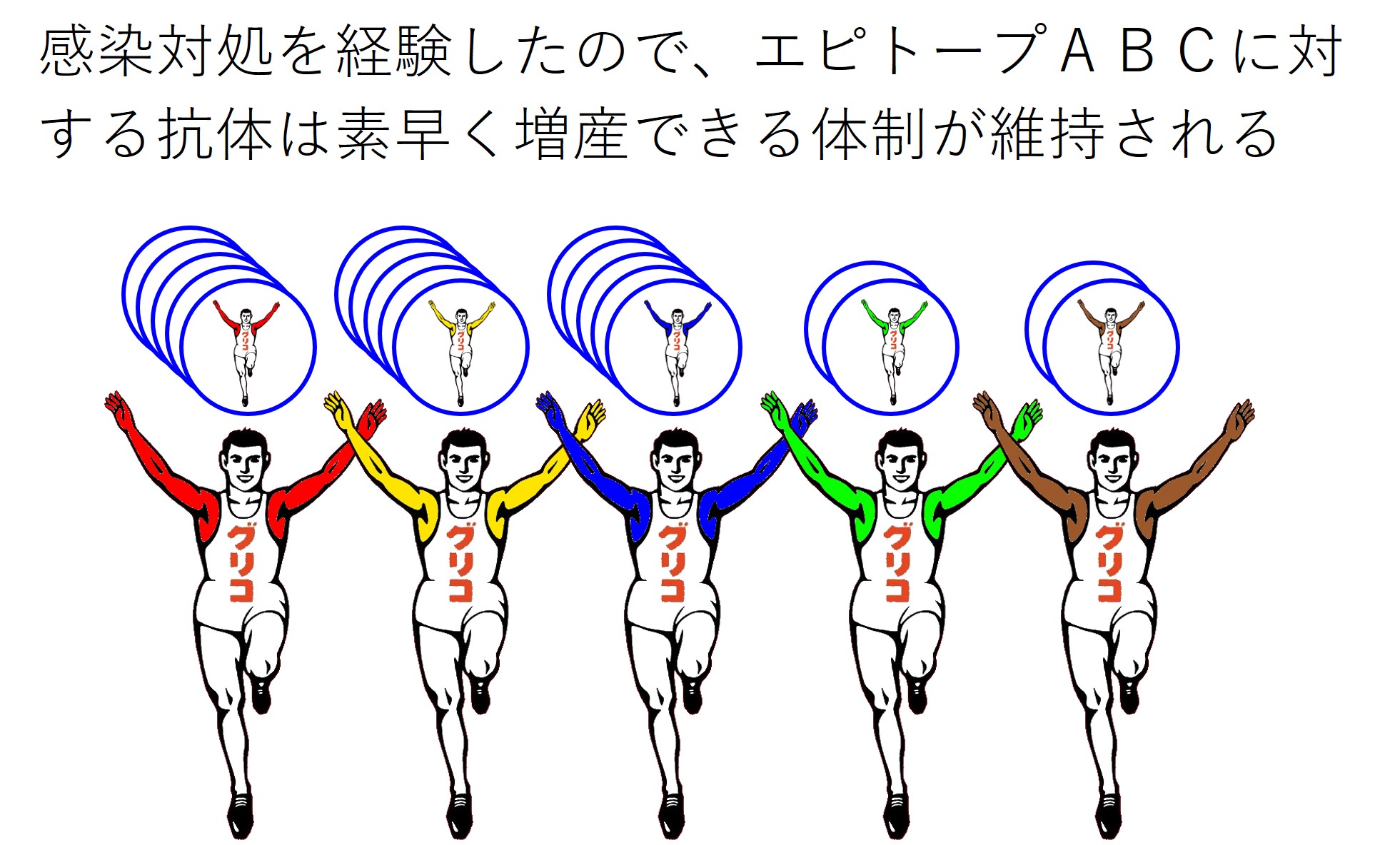
武漢株のスパイクタンパクを作るmRNAワクチン(ファイザー社やモデルナ社の初期タイプ)を接種した人は、3つのエピトープ(ABC)に対する抗体を産生します。
これらの抗体を産生する免疫細胞の数が数万倍に増加します。
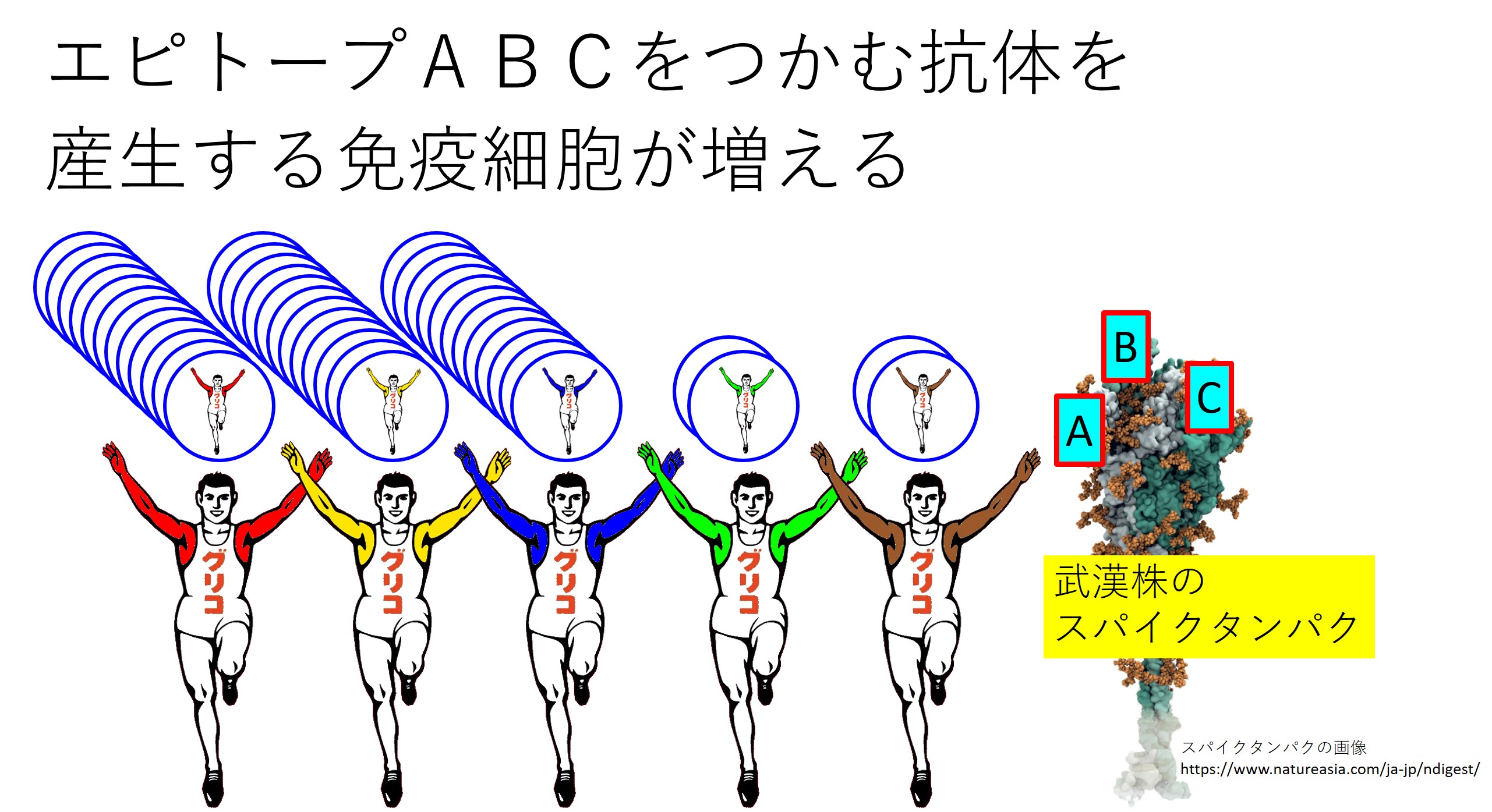
十分長い時間が経過すると(コロナの場合は数か月と短い)、抗体を産生する免疫細胞の数は減少しますが、ふだんよりは多くの数が維持されます。
また、感染対処を経験したエピトープABCに対する抗体を産生する免疫細胞は、次の同様の感染に対して素早く反応して数を増せるような仕組みが構築され、維持されます。
このとき、オミクロン株の感染がおこると(あるいはオミクロン株のスパイクによるワクチン接種がおこなわれると)、どのような抗体が作られることになるのでしょうか(→下図)。
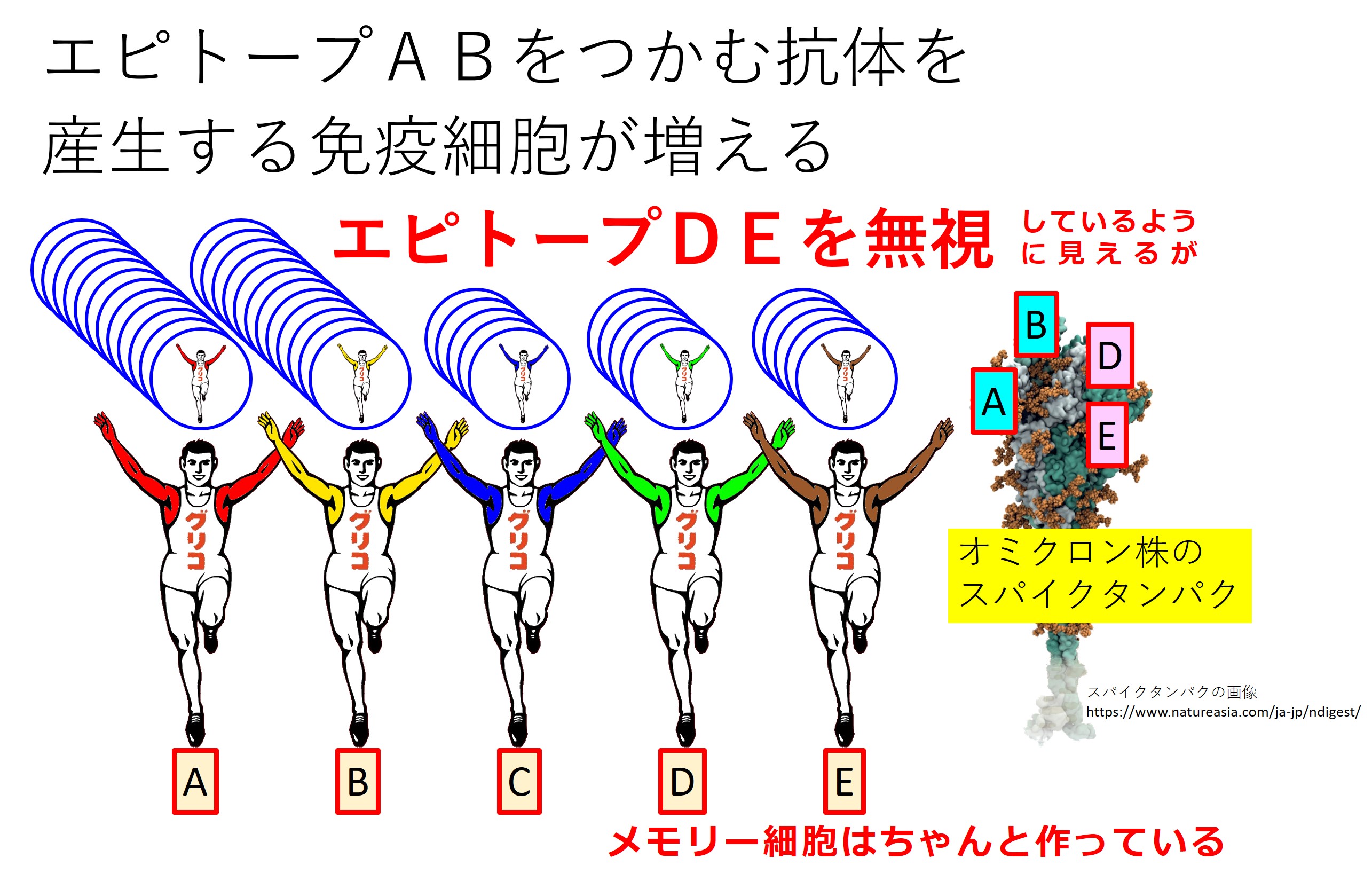
武漢株とオミクロン株との共通エピトープに対する抗体のみで頑張る。

これが免疫刷り込みです。
すでに増産体制の整っているエピトープ(AB)に対する抗体の増産で対応して済ませる。
免疫系の手抜きですね。
免疫刷り込みが起こる正確な理由はわかっていないようです。
コロナに対しては、抗体がさほどイイ働きをしていないことを考えると、別に免疫刷り込みが起こっても気にすることはない、とも言えます。
しかし、スパイクタンパクにくっつく抗体の数が少なすぎると、ADE:抗体依存性感染増強という新たな問題の生じることがあるようです。
また、もっと深刻な問題は、(抗体を使わない)細胞性免疫にも抗原原罪が起こるということです。
細胞性免疫は、ウイルスに感染した細胞を見つけて殺します。
mRNAワクチンは、細胞性免疫をも刺激して感染に備えさせるようなので、そちらで抗原原罪が起こると感染細胞をうまく殺せないことになります(見逃しが増える → ウイルス増殖を許してしまう)。
幸いなことに、細胞性免疫が敵を認識する仕組みは、液性免疫(主役は抗体)と比べて変異に強く、抗体から逃避できるように変異したスパイクをもしっかりと捉えるようです。
「免疫刷り込み」と「抗原原罪」とは、同じような現象なので区別しない人も多いようです。
区別する場合は、次の点の違いで区別するようです。
抗原原罪は、たとえばインフルエンザを例とすると、人生で最初に遭遇したインフルエンザについて何十年と続く強い免疫記憶が焼き付けられ、その後、色々と変異したインフルエンザに感染しても、毎回最初のインフルエンザのことを思い出して、最初のインフルエンザと共通のエピトープに対する抗体しか作らなくなることを指すようです。
免疫刷り込みは、先行感染(過去の複数回の感染)との共通エピトープに対する抗体だけが増産され、後行感染固有のエピトープに対する抗体が少ししか作られないというものです。
したがって、同じウイルスに繰り返し感染した時は、2回目以降は固有エピトープに対する抗体が産生されます。
「3-5.感染例からコロナの免疫を知る」で免疫刷り込み(≒ 抗原原罪)の実データを紹介します。
いろいろな人が「免疫刷り込み(≒ 抗原原罪)」の説明を試みていますが、あまりお奨めできるものはありません。
参考ページを見ると、かえって混乱する恐れがあります。
参考:抗原原罪について (【免疫学者Cal】, 2022.06.14)
一般向けとしては、あまりお奨めではない参考:免疫学的インプリンティング: COVID-19 を理解する (カイン, 2023.04.21)
一般の方は、以下↓は無視してください。
◆ 専門家による研究等を読みたい方はコチラ↓:ものすごく口の悪い「ラモス2号」さんのツイート

ラモス2号さんのツリーを辿れば出てきますが、まずは、荒瀬尚(大阪大学)等の研究グループによる発表が紹介されています。
↑研究紹介はこちら: プレスリリース 新型コロナウイルスの感染を増強する抗体を発見―COVID-19の重症化に関与する可能性―
引き続き、口の悪いラモス2号さんのツリーより、カタールでの研究:1度目のオミクロン株感染後、2度目の感染状況をワクチン接種回数で比較
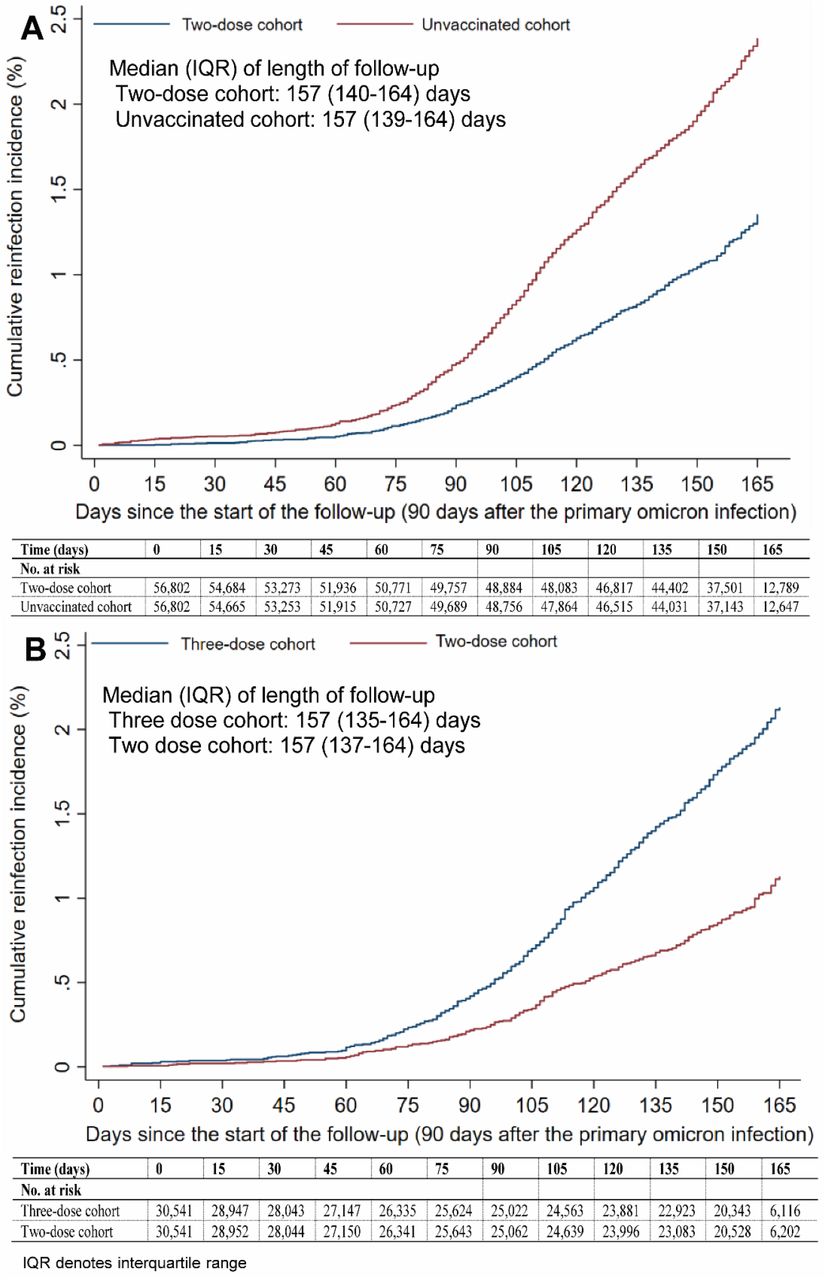
↑論文はこちら: COVID-19 primary series and booster vaccination and immune imprinting
同じく、暴言癖のあるラモス2号さんのツリーより「2価ワクチンの効果に見られた抗原原罪効果」(米国クリーブランドクリニック)
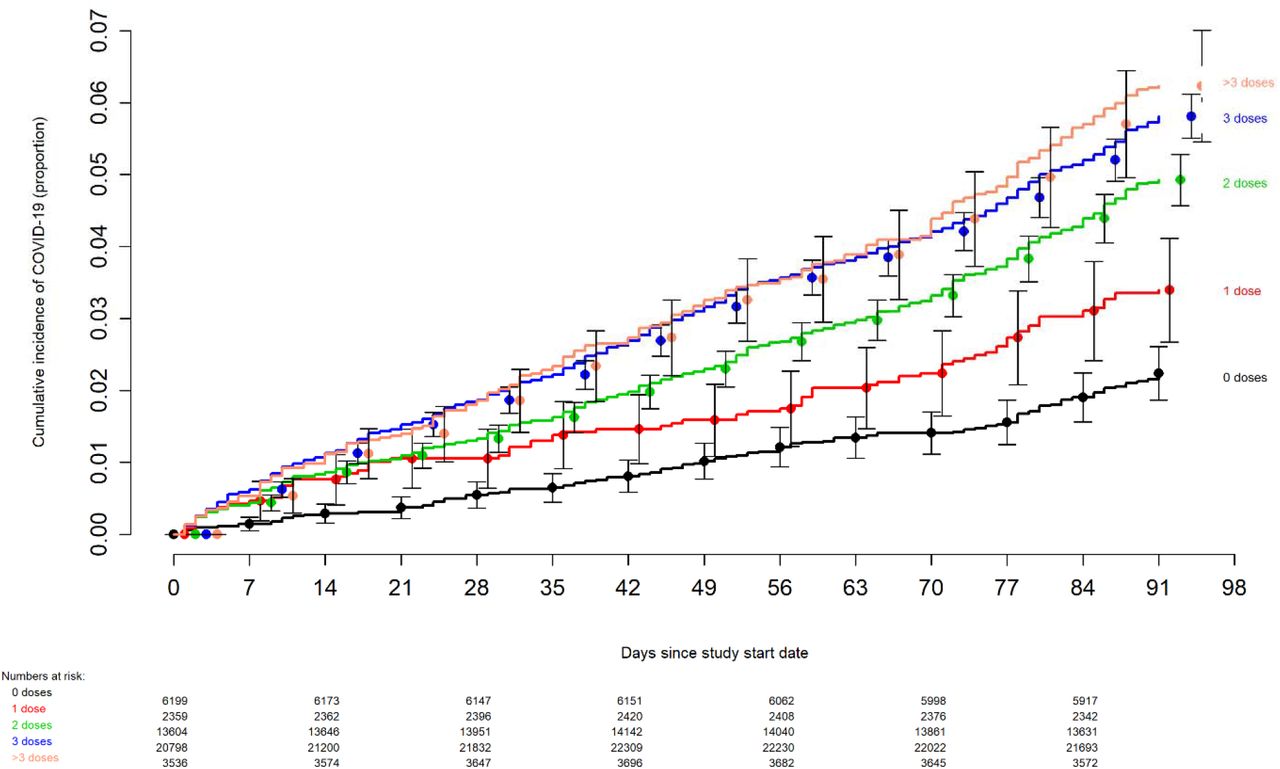
↑論文はこちら: Effectiveness of the Coronavirus Disease 2019 (COVID-19) Bivalent Vaccine
◆ 抗原原罪やADE以外でも注意を向けるべき現象 が起こっているようです。
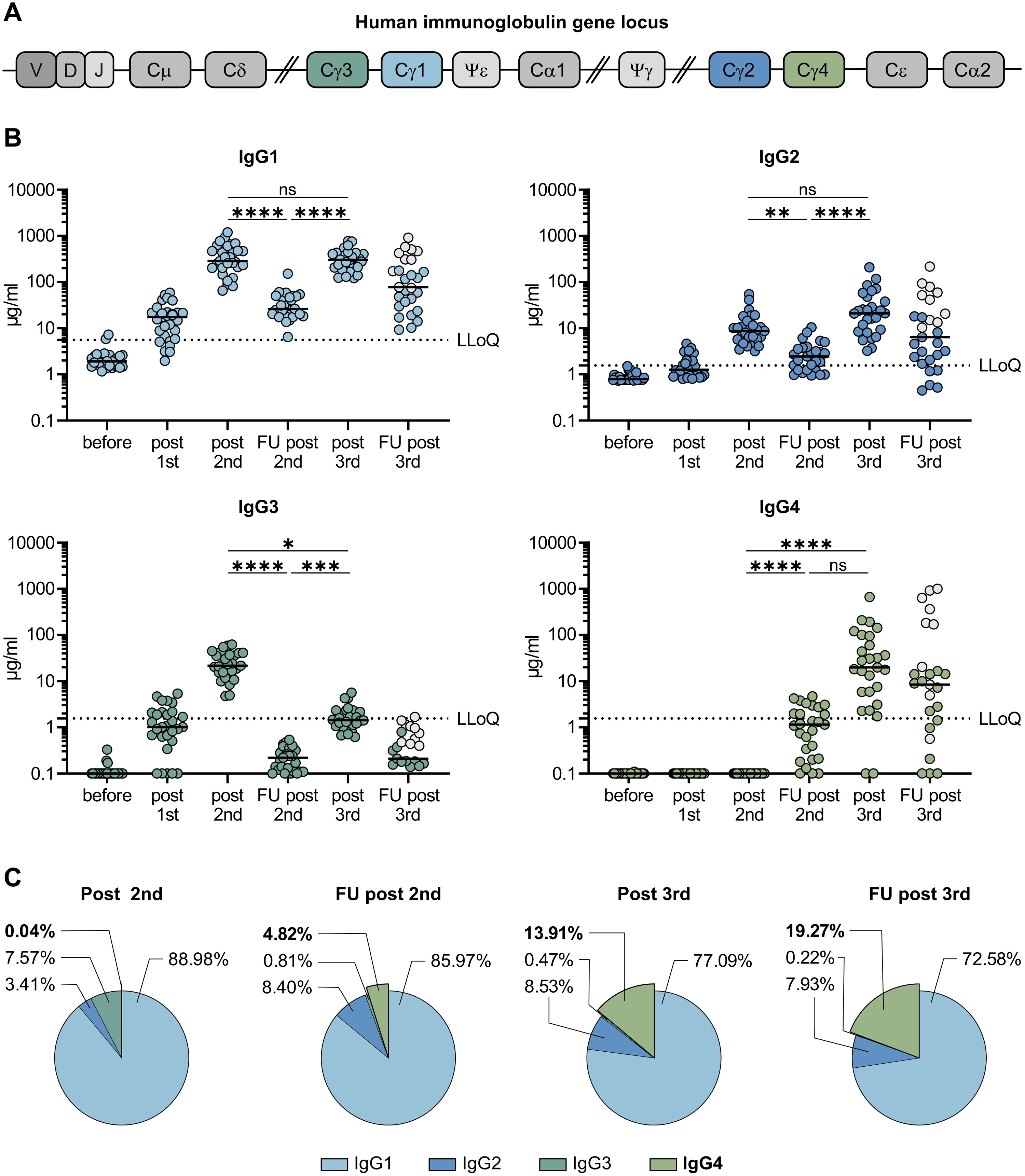
繰り返し接種により、抗体のタイプが「IgG1、IgG3」→「IgG4」へと クラス スイッチ していくようです。
その臨床的な意味合いはまだ不明です(現在、繰り返し接種の皆さんが人体実験中です)。良いことか?、悪いことか?、まだわかりません。
スギ花粉症の減感作療法で、同じような クラス スイッチ が起こるそうです。はたしてアレルギーと同じように、コロナウイルスのスパイクタンパクに対して免疫系が、のらりくらりとした応答になるのでしょうか?。
ステファニー・セネフさんのツイート↓

ネコのコロナウイルスの実験でも、ネコが死んでいく前に同じような クラス スイッチ (IgG4 が増える) が観察されているようです。
Stray, a student of comparative pathology @K9FCR さんのツイート↓

以上で、抗原原罪とは何か、逃避変異とは何か、手抜き説明を終わります。
詳細は「接種時期選定の参考」で説明しています(まだしていません。これから作る予定です)。
参考:抗原原罪について (【免疫学者Cal】, 2022.06.14)
一般向けとしては、あまりお奨めではない参考:免疫学的インプリンティング: COVID-19 を理解する (カイン, 2023.04.21)