接種時期選定の参考
補足説明8:2度目の感染


リンク元のページに戻るときは、ブラウザの「戻る(<)」機能をお使いください。次の「▶ ▶ ▶」を使っても戻れますが、リンク元ページを「新たに読み込む」ことになり通信量が大きくなります:リンク元へ戻る:▶ ▶ ▶
今回は、いきなり主要な検査結果を報告します。(このウェブページは記録を兼ねているのでどうしても記述量が多くなりますが)ダラダラとした経過説明等は後回しにして、データを検討して到達した結論を先に述べます。
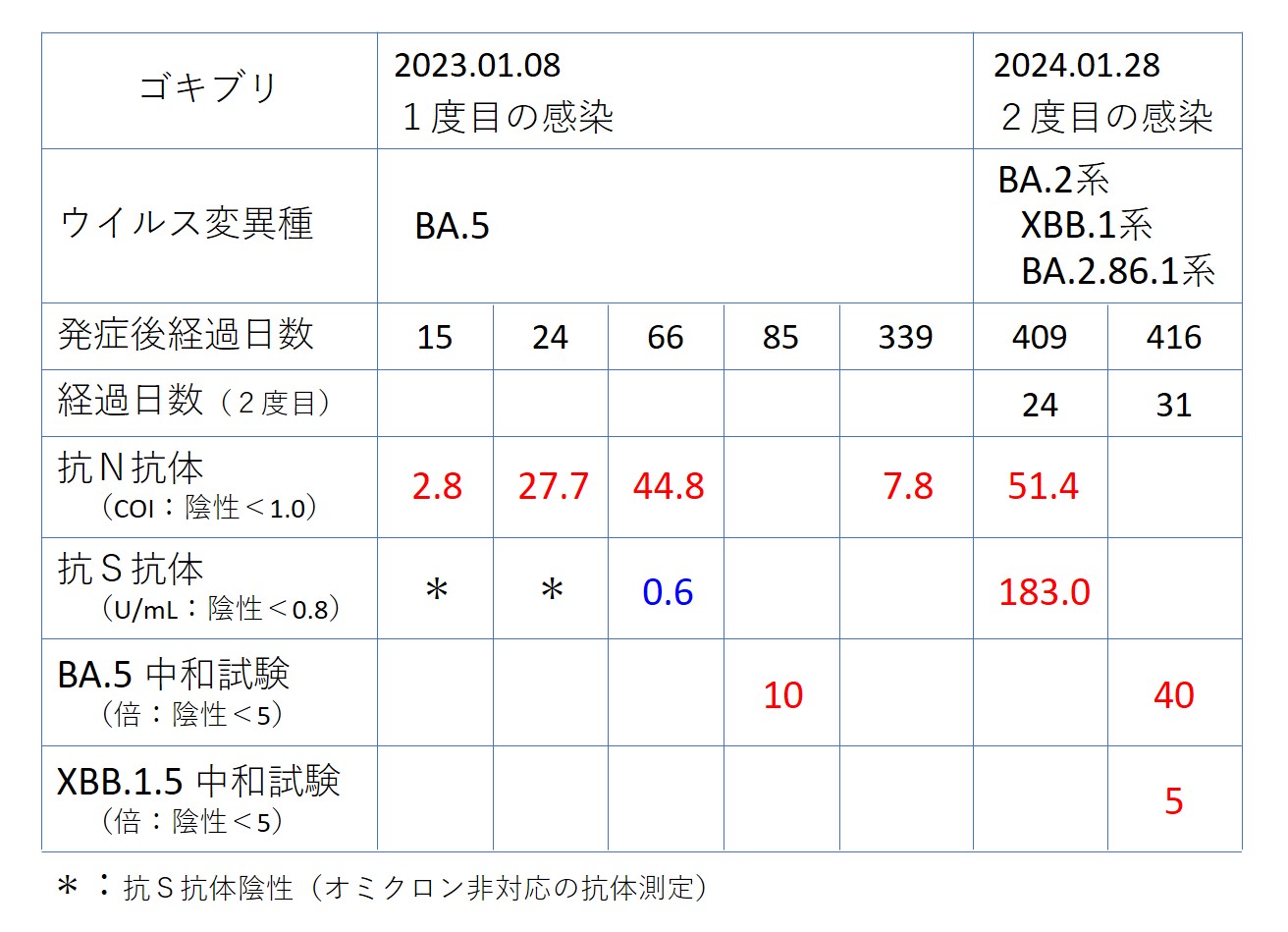
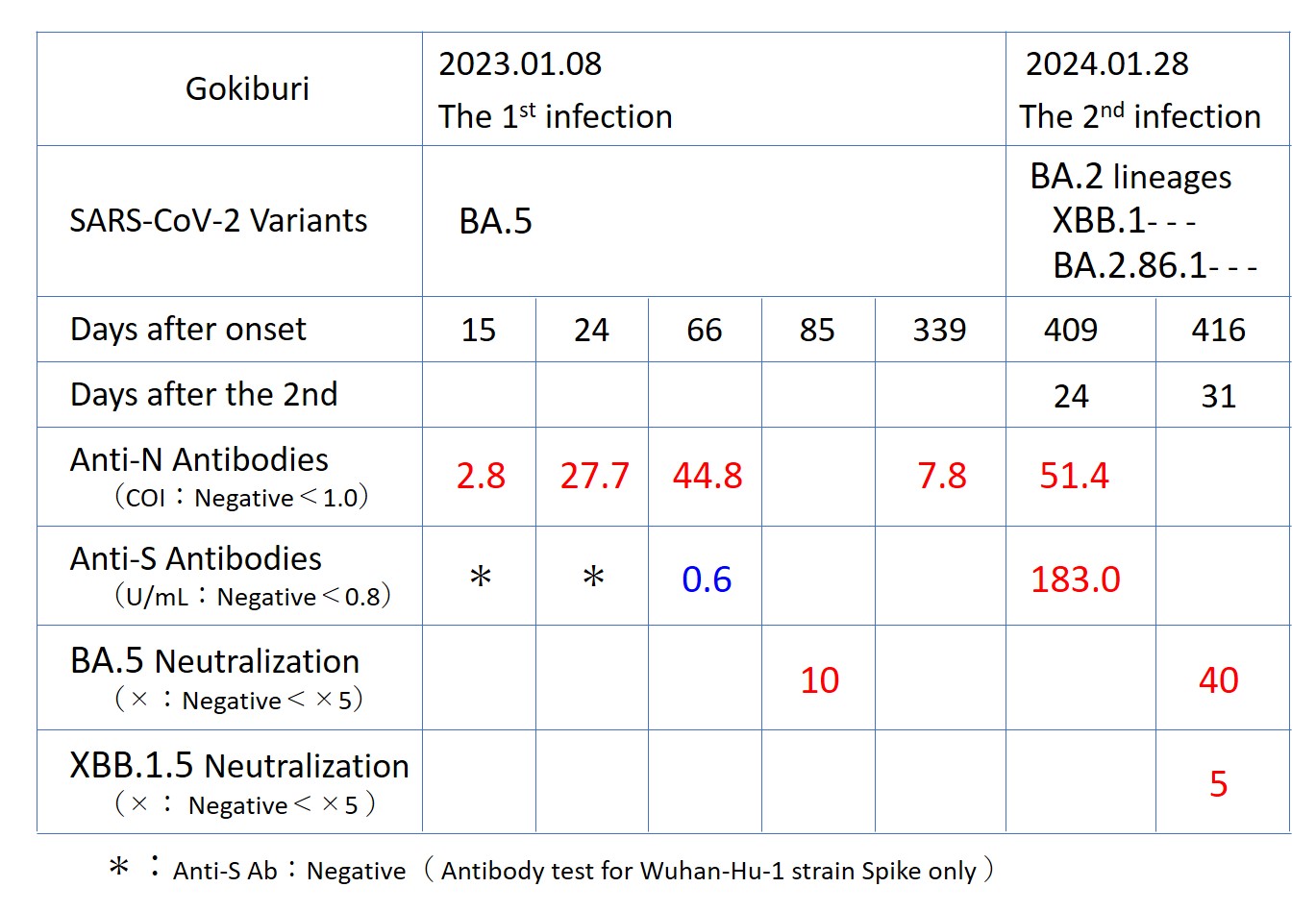
次の表の右側2列が今回の検査結果です(この表では 左 → 右 と時系列でデータを置いています)
感染したウイルス変異種の検討はウェブページ後半に載せています:SARS-CoV-2 の変異情報
1度目の感染は「BA.5」でした。
2度目の感染は、次の系列の可能性が大きいと考えられます。
今回は、検査オーダーの手違いがあって、先にウイルス中和試験の結果を知り、後で抗体検査の結果を知りました。
ウイルス中和試験は、前回感染の「BA.5」と今回感染の「BA.2系」に属する「XBB.1.5」の2種類でお願いしました。
1度目の感染時、ウイルス中和試験の結果は「BA.5:10倍」であり、発症85日目としては低く、また抗S抗体は産生されていないことを確認していたので、ふだんからゴキブリにはコロナウイルスの種類を問わず「10倍前後(5倍~10倍~20倍)」の中和能力(感染で出来る抗S抗体に拠らない中和能力)があるのだろうと考えていました。
そのため、2度目の感染後の「BA.5:40倍」という結果を見たとき、ふだんの中和能力としてはさすがに高すぎるだろうと感じました。
「(おそらく糖鎖を認識する血液型抗体等による)ふだんからの中和能力」はそれほど大きく変動しないはずです。
また、もし「ふだんからの中和能力」という解釈が間違っていて(・・・ロシェ社の検査キットによる検出から漏れた抗S抗体である可能性はありますから)、「BA.5」に対する抗S抗体による中和能力「10倍」だったとしても、今回の2度目は「BA.5」とは大きく抗原性の異なる変異種に感染したはずなので、中和試験の結果が「BA.5:40倍」と大きくなるはずがありません。
「XBB.1.5」に対する中和試験も同じくらいの結果「20倍~40倍~80倍」であれば、「ふだんからの中和能力」でも説明できるので「BA.5:40倍」に納得できたでしょうが、こちらの結果は「XBB.1.5:5倍」とかなり低く、(この時点では、抗S抗体の測定結果が届いてなく、抗S抗体は無いとゴキブリは思い込んでいるので)この差異の原因が不明で困りました。
「BA.5:40倍」、「XBB.1.5:5倍」というウイルス中和試験の結果は、「感染で出来る抗S抗体には依存しないふだんから持っている中和能力」だけで理解するのは無理でした。
数日遅れて抗体の検査結果が届いた時、抗S抗体陽性 の結果(しかもかなりの量)を見てゴキブリはビックリしました。
今回は、「感染で出来る抗S抗体」が働いて中和試験「BA.5:40倍」という結果になったようです・・・(→ この解釈は整合性が無く・・・半分以上間違いです)。
2度目の症状が軽かったのは、1度目の感染で強化された細胞性免疫が頑張ったお陰であると考えていましたから、「液性免疫もがんばったぞ」という証拠を突き付けられたような気がしました・・・(→ これも間違いです・・・あとで修正していくことになります・・・液性免疫は役に立っていませんでした)。
ゴキブリの予想は大外れ、「予想3」が当たったわけですが、おかしな点が幾つかありました。
抗体検査の結果とウイルス中和試験の結果を合わせて検討すると、今回ゴキが産生した抗S抗体は、2度目に感染したオミクロン変異種(BA.2系の変異種)のスパイクに対する抗S抗体ではなく、1年前最初に感染したオミクロン「BA.5」に対する抗S抗体だと考えられたのです。
1度目の「BA.5」感染による「免疫刷り込み」(immune imprinting、immunological imprinting)あるいは「抗原原罪」(original antigenic sin)」がおこったと考えられました。
また、「BA.5」に対する抗S抗体の量(183.0 U/mL)はそれなりの中和活性を示すのに十分な量であり、抗体測定とほぼ同時期の血清を用いた「BA.5」の中和試験で「160倍以上(~320倍~640倍など)」の結果が出てもおかしくないのに、実際の結果は「40倍」とかなり低かったのです。(注:このあたりの詳細な比較検討はページの後半部に記載しています)
前回は抗S抗体陰性なのに中和試験「BA.5:10倍」、今回は十分な量の抗S抗体があるのに「たった40倍」?(・・・どういうこと?)
抗S抗体の量とウイルス中和試験で示された中和能力が不釣り合いでした(抗S抗体は多量にあるけれど、中和抗体としての性能が悪いということ)。
次の2段落と図は小難しい話になるので一般の方は飛ばして下さい。(今後の考察に使用しません。一般向け解説もここではしません。)
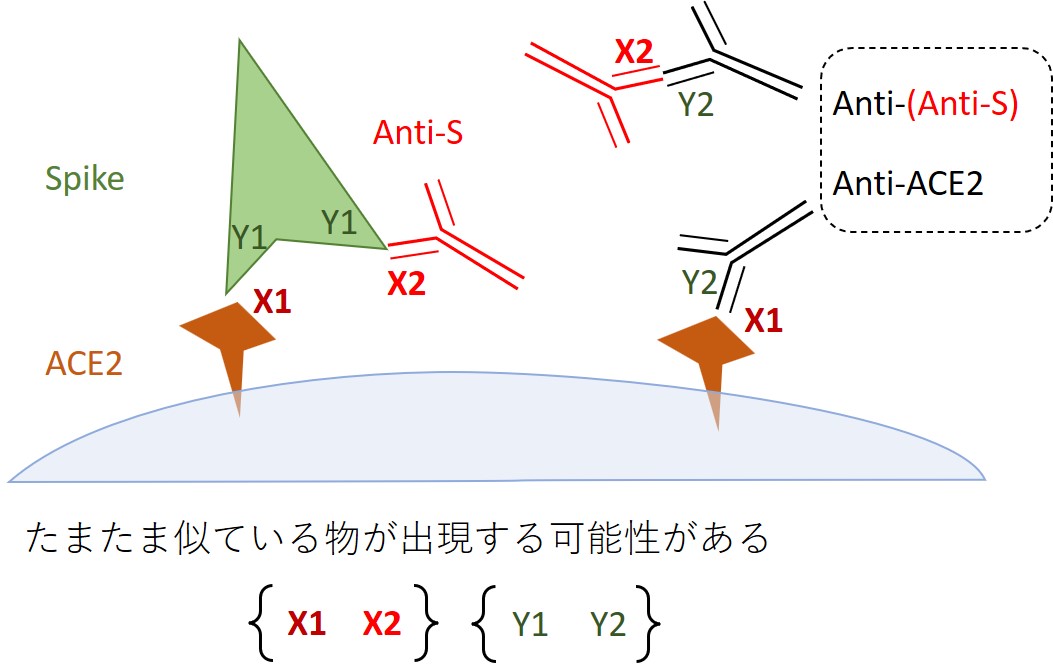
「BA.5」に対する抗S抗体の量(183.0 U/mL)が多いのに、「BA.5:40」と中和能力が低くなった原因として抗イディオタイプ抗体である抗ACE2抗体が、「BA.5」のスパイクに対する抗S抗体に結合して「BA.5」ウイルス中和試験を「40倍」に低下させたのではないかという指摘も受けました。
このような「抗ACE2抗体=抗抗S抗体」の存在はウイルス中和試験だけでなく、 Roche の検査キット「Elecsys Anti-SARS-CoV-2 S RUO」にも悪影響を与えるはずです(化学反応の背景に拡がるノイズのようなもの)。
何かがおかしい気がしましたが、(・・・さすがはゴキブリ・・・)とりあえず全データが揃ったので結論(第1結論)を仕上げました。
2度目の感染の抗体検査等の結果は、1度目の感染による免疫刷り込み(≒抗原原罪)でだいたい説明できます。
「だいたい」というのは、「免疫刷り込み」を導入することで多くの疑問は解消するのですが、それでも残る課題があるということです。
その残る課題は、次に「×××」を導入することで全てキレイに解決することになります(第2結論)。ネタバレになるので、ここでは「×××」としておきます。
さて、このページの訪問者には一般の方もいらっしゃいますので、結論(第1結論)の前に免疫刷り込み(≒抗原原罪)を説明しておきます。
液性免疫(抗体産生)におこる免疫刷り込みについて説明します。
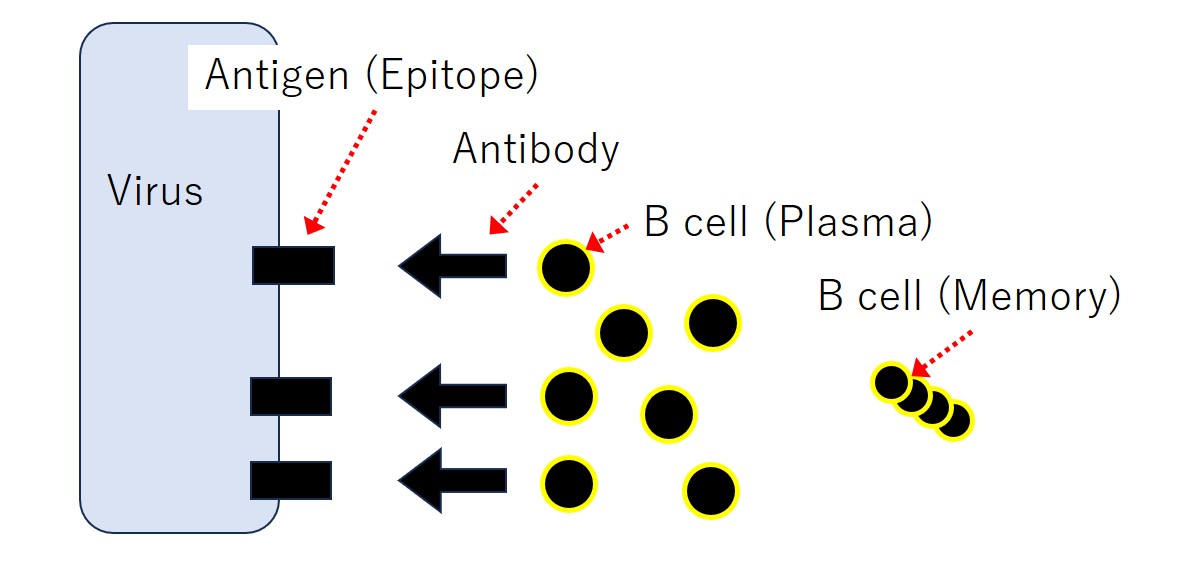
ウイルスなど病原体の表面には 抗原(Antigen) があります。抗原とは 抗体(Antibody) が結合する物質(異物;敵;非自己)のことです。抗体は リンパ球(B細胞) が産生します。
コロナに罹った人やコロナのワクチン接種を受けた人のリンパ球はコロナウイルス(のスパイク)に結合する抗体を産生します。
コロナウイルスのスパイクタンパクは大きな抗原ですが、抗体はスパイクのどこにでも結合するわけではありません。抗体の強く結合する部分が10か所とか20か所とかあります(注:数は適当に言っています)。
抗体の強く結合する部分は、たいてい5個~8個くらいのアミノ酸が連なったペプチド(小さなタンパク)です。それは抗原の最小基本単位のような部分であり、エピトープ(Epitope) と呼ばれています。
基本的に、1種類のエピトープには1種類の抗体が対応し、1個のリンパ球(B細胞)は1種類の抗体のみを産生します。
本来、ヒトの免疫系はスパイクのあらゆる部分に結合できるようにあらゆる種類の抗体を産生する能力を持っているのですが、自分の身体がもともと持っているタンパクと同じ(5個~8個の)アミノ酸配列(自己抗原)に結合する抗体(自己抗体)は多量に産生しないように制御されています。
さて、ここでは「ウイルス A」に感染後、「ウイルス B1」、「ウイルス B2」、「ウイルス B3」という順に感染したときに抗体産生がどうなるかを見てみましょう。「A と B」は少し遠い関係のウイルスであり、「B1 ~ B3」は近い関係の変異種とします。
次図では、エピトープ(抗原)の種類を色で区別しています。
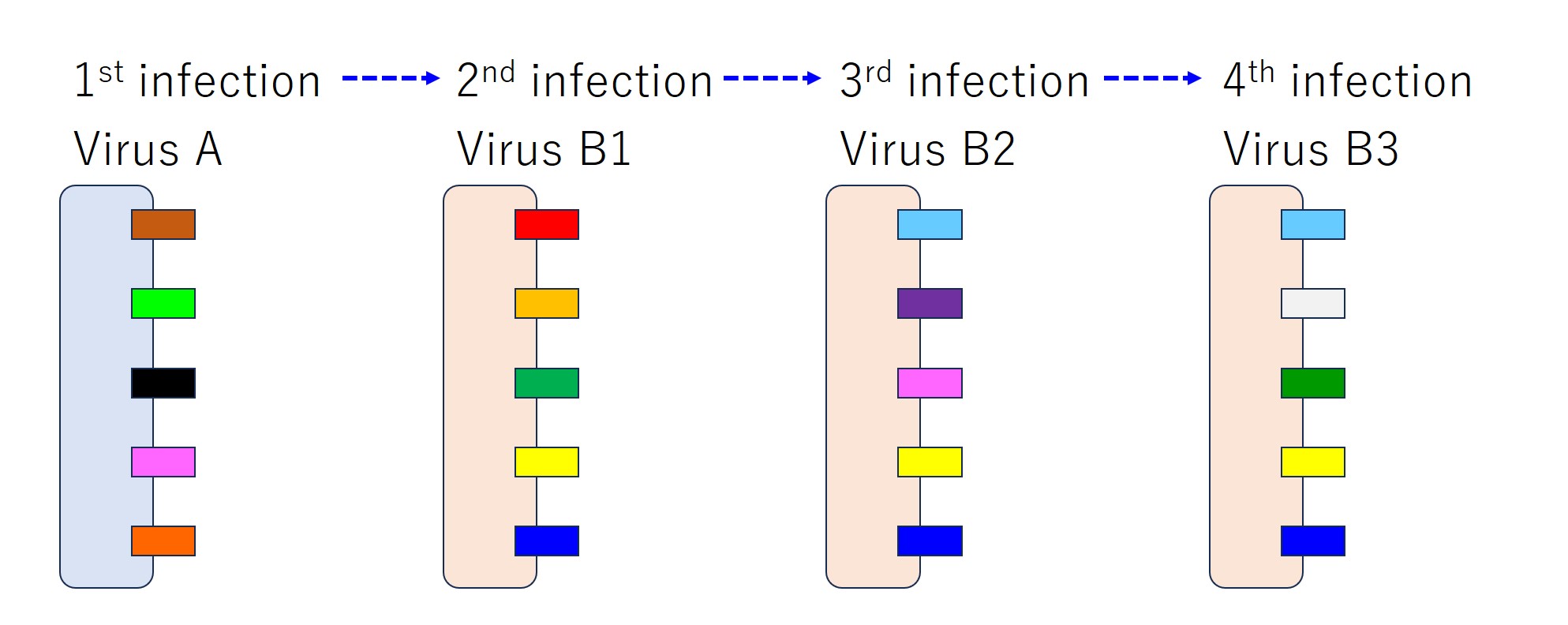
もし仮に、感染が起こるたびに毎回ウイルスの持つすべてのエピトープに対して抗体が産生されると、次図のようになります。
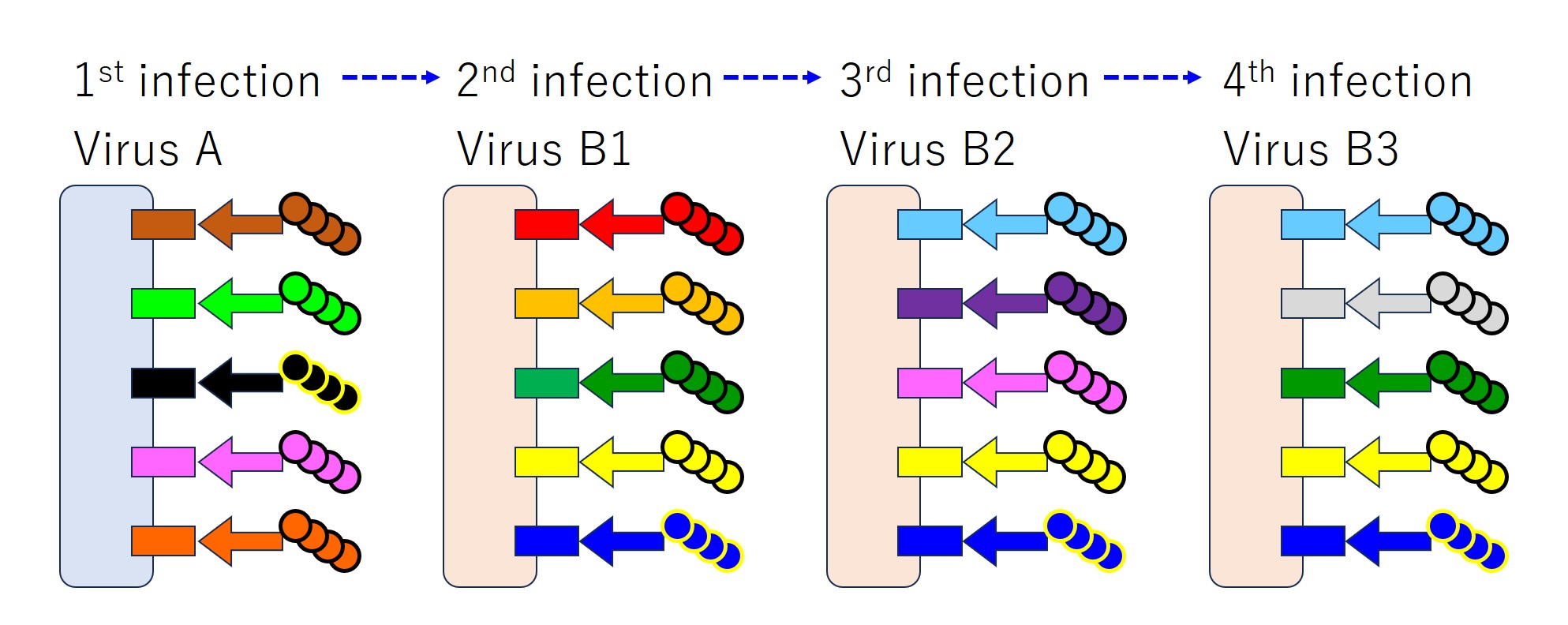
毎回、感染で産生される抗体がしっかりと全エピトープに結合して、ウイルスの感染力を弱めます(中和します)。
ところが実際には、(コロナウイルスに対しては)免疫刷り込みがおこり次図のようになります。
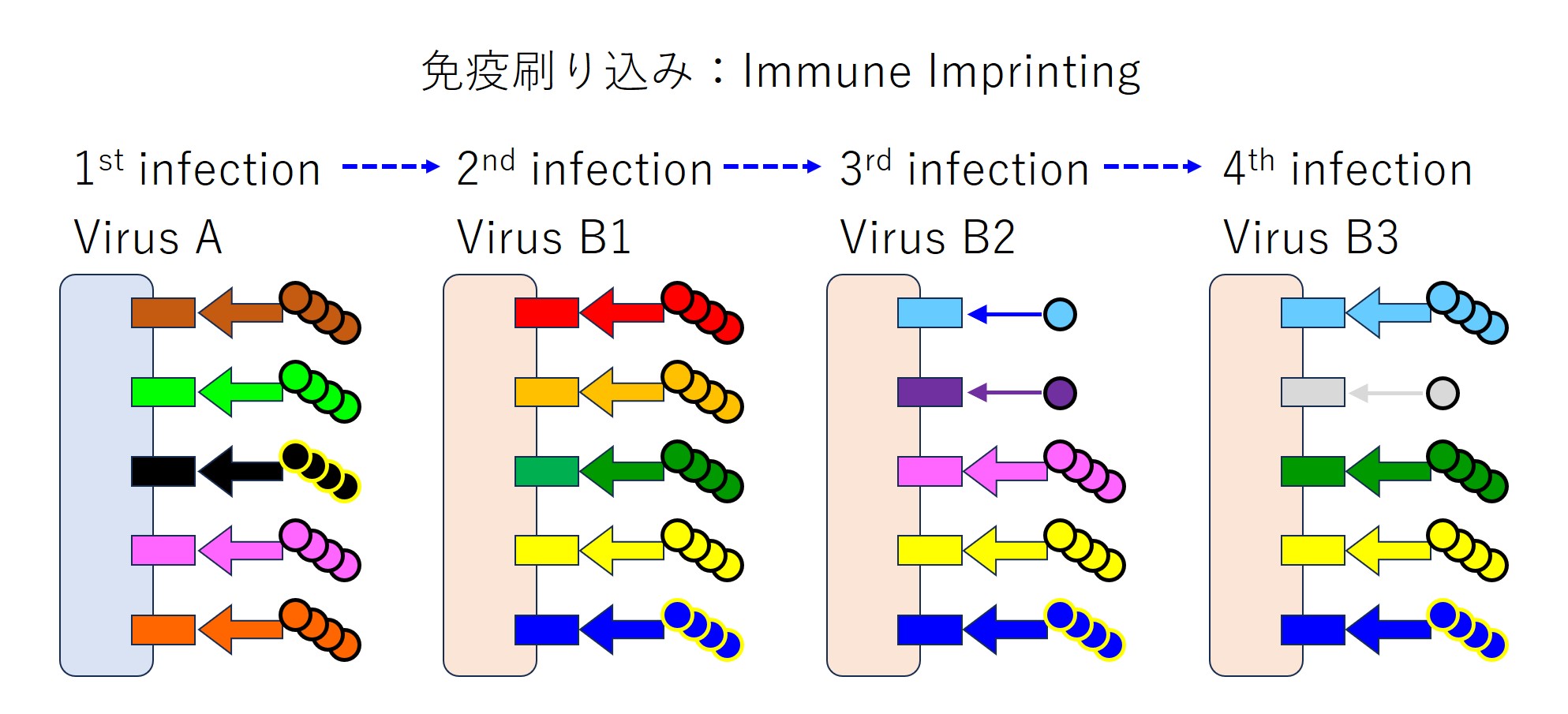
上図を順に説明します。
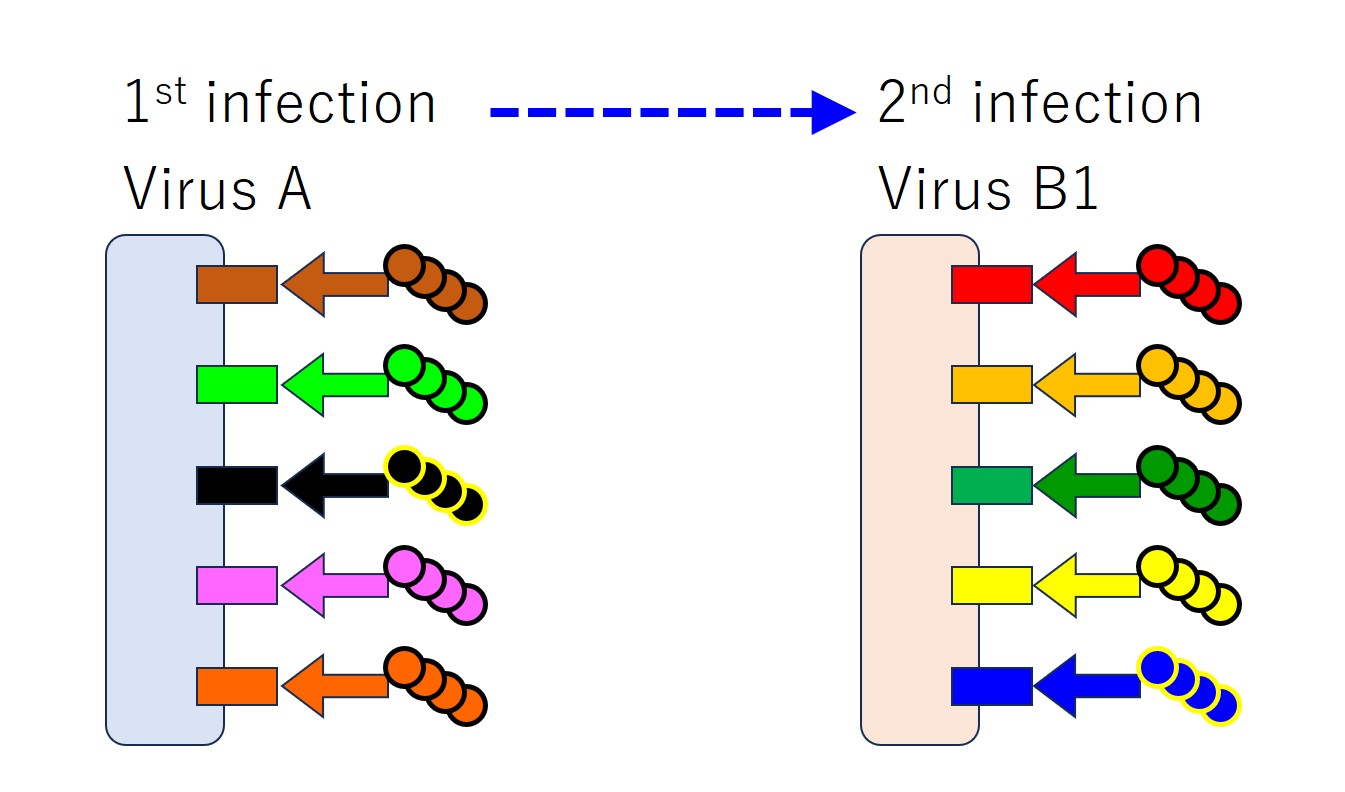
「ウイルス A」と「ウイルス B1」に「共通するエピトープ」が少ない場合、毎回すべてのエピトープに対する抗体が産生されます・・・(共通の度合いがどの程度であれば全エピトープに反応するのか私は知りません)。
感染症の治った後も、それぞれの抗体を担当するリンパ球(B細胞)が 記憶細胞(メモリー細胞)として残り続けます。
次に同じウイルスに感染したときは、残っていた記憶細胞がすぐに増殖して有効な抗体を大量に産生し、ウイルスの感染を抑えます。同じウイルスの再感染に対して「免疫」されるわけです。
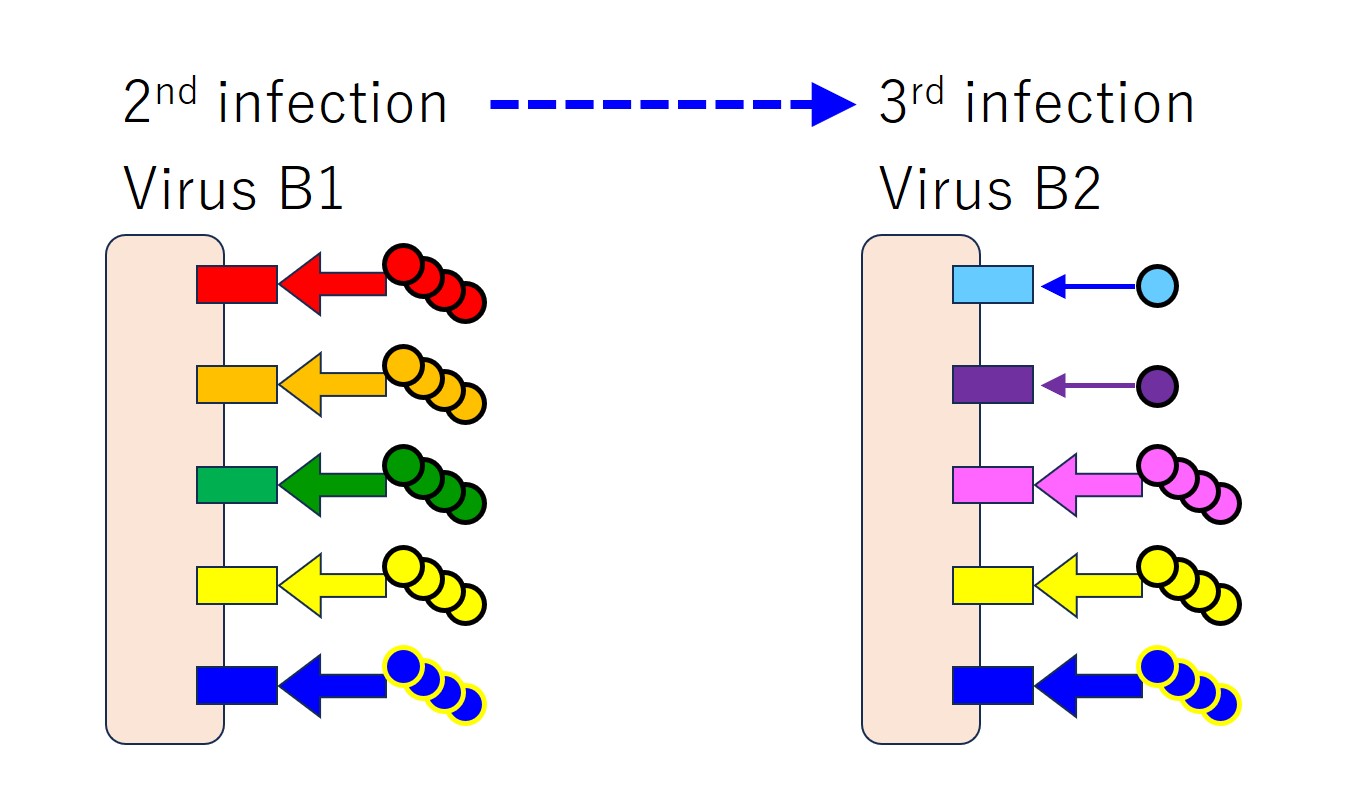
似たようなウイルス(つまり変異種)に続けて感染すると、免疫刷り込みがおこります。
先行感染のウイルス(B1 と A)と後行感染のウイルス(変異した B2)との共通エピトープに対する抗体のみをたくさん産生します。
先行感染のウイルスには無く、後行感染のウイルス固有のエピトープに対する抗体も中和抗体として役立つはずなのですが、少ししか産生しないのです。
免疫刷り込みは、人間社会における「前例主義(先例主義、事なかれ主義、お役所仕事・・・)」に似ています。
ほぼ同じ変異ウイルスに再度感染したとき、免疫系は「どうせ似たようなウイルスだろ。こちらの抗原は以前に抗体を作ったことがあるね。図面(鋳型)はあるからすぐに抗体を作るよ。大量生産するよ。でも、あちらはダメだな。過去に例がないよ。あんな新しい抗原に対する抗体は作ったことがない。だから今回は抗体を作らないよ。申し訳ないね。」とばかりに、過去に未体験のエピトープに対する抗体産生をサボるのです。しかし、また同じ注文を受ける可能性に備えて図面だけは用意し、また少し試作もするようです・・・免疫刷り込みの場合は・・・しかし、その図面さえ作らないのが抗原原罪(・・・あとで説明します)。
その結果、後行感染のウイルスに結合して感染力を弱める働きは小さくなりますから(ウイルス中和能力は低下しますから)、[液性免疫の比重の大きい感染症の場合は]先行感染時よりも重症化する恐れがあります。しかしコロナのように細胞性免疫の比重が大きい感染症では、重大な影響はないようです。
また、実際に抗体を産生したリンパ球の一部が記憶細胞に変化して残るわけではなく、感染の初期段階で最初から記憶細胞として増えるようです。
つまり、実際には抗体を大量に産生しない場合も記憶細胞は作られている可能性があります(図面だけは作って将来の注文に備えるようです)。
こういう話が、実験等で確認されているのか、仮説にすぎないのか、ゴキは免疫学者ではないので知りません。免疫学では、準定説化した仮説がいつのまにか反証されて消えていくといったことの起こることが珍しくありません。
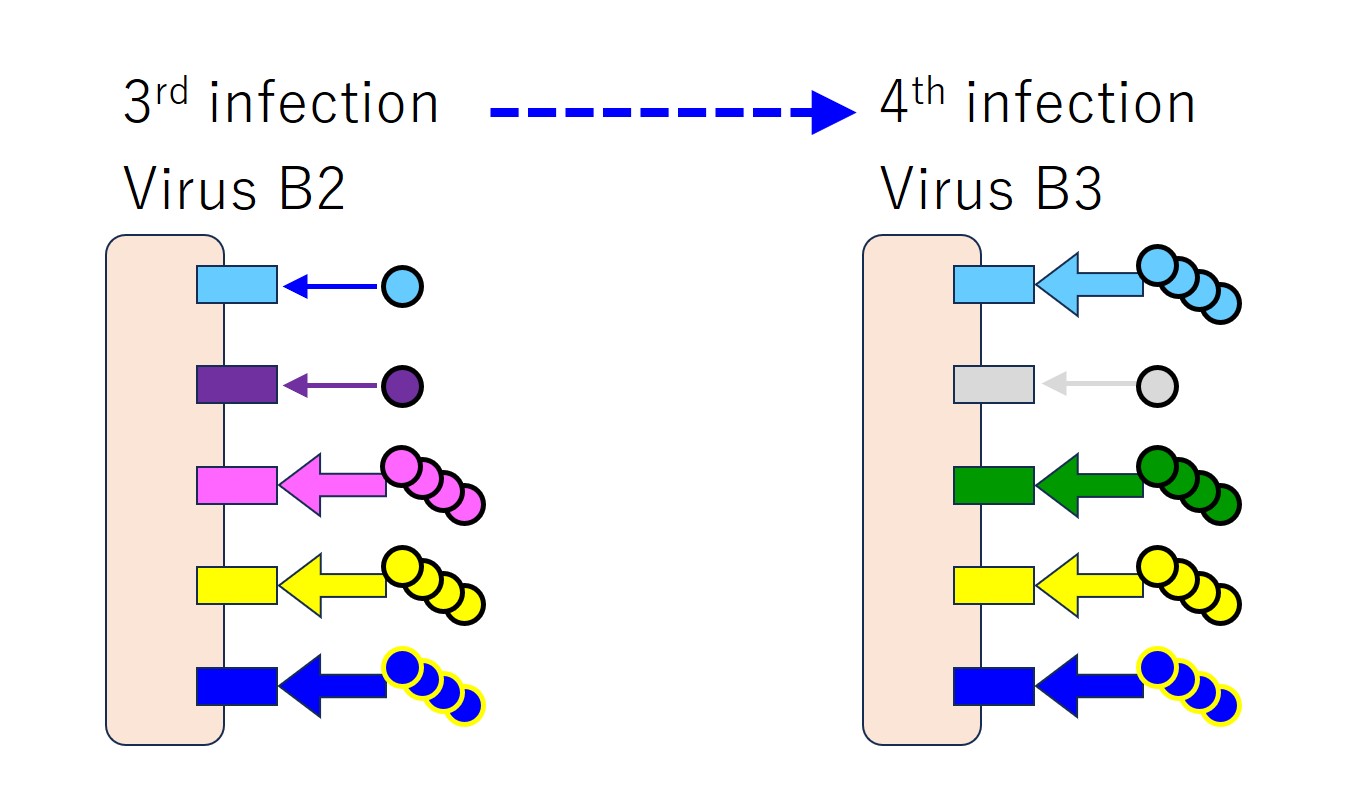
再度、同じウイルス(変異した B3)に感染すると、また先行感染ウイルス(B2、B1、A)との共通エピトープに対する抗体のみをたくさん産生します。
4回の感染を連ねると下図になります(マチガイがあるかもしれません)。

以上が、免疫刷り込みの概略説明です(詳しいことは私も知りません)。
何年先までの先行感染が免疫刷り込みとして影響を及ぼすのか、そういったことはウイルスによって異なるかもしれません。
最初の感染時の免疫的学習が、その後の繰り返す同種ウイルスによる感染にずっと影響を与え続けるのが「抗原原罪(Original Antigenic Sin)」です。次図のようになります。
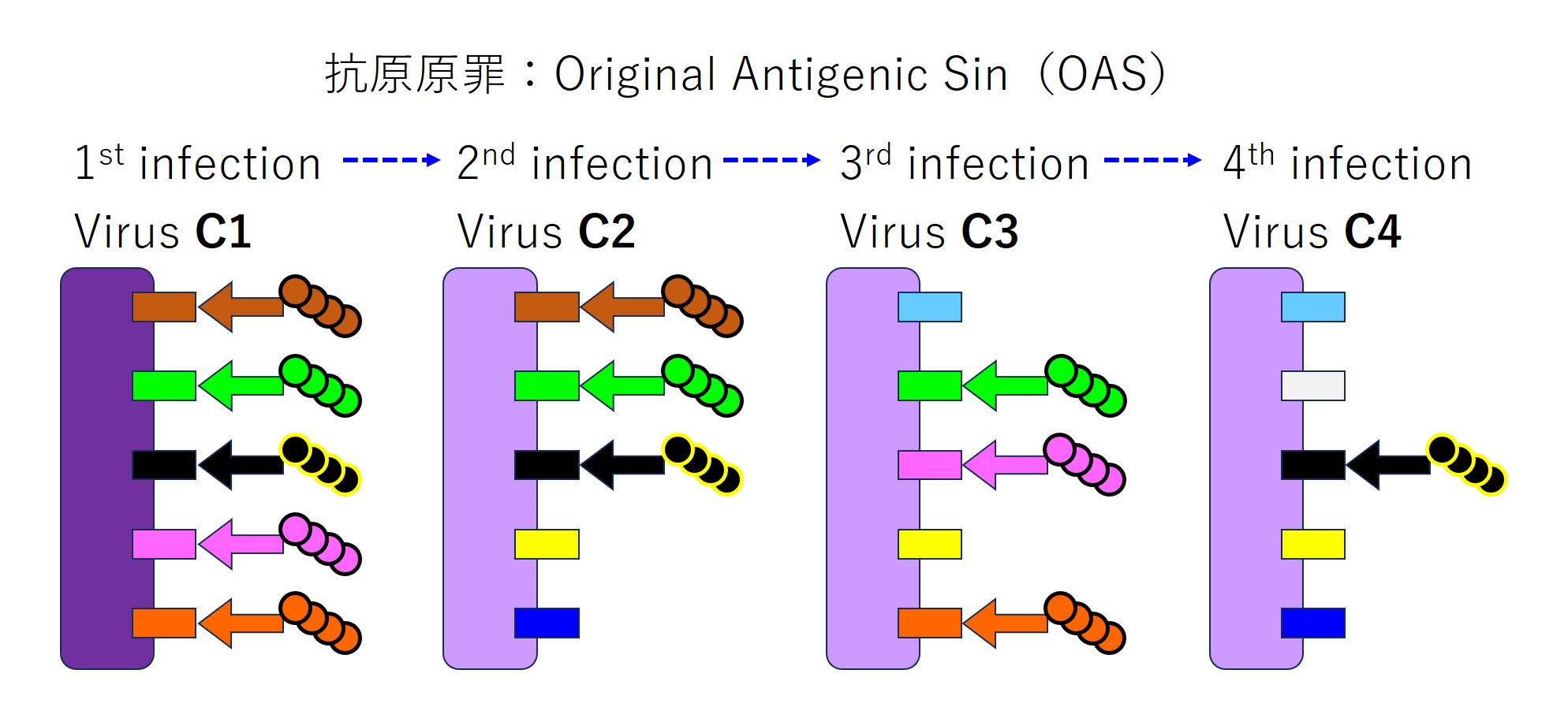
抗原原罪はかなり深刻です。新しいエピトープに対する抗体が産生されないだけでなく、記憶細胞も作られません。
しかし実際には、「免疫刷り込み」と「抗原原罪」の起こる仕組みの違いは解明されておらず、もしかすると両者の起こる基本的な仕組みはほとんど同じであって、単に起こることの程度の差にすぎない可能性もあります。
そのため、「免疫刷り込み」と「抗原原罪」とを同じ現象として扱っている人もいます。
このウェブページでは、便宜上の理由で、「免疫刷り込み」と「抗原原罪」の意味を区別します。
おそらく、免疫刷り込みは、感染するたびに毎回起こっていると考えられます。「A」の次に「B1」に感染した時は、免疫刷り込みの影響を受けるエピトープが少なすぎて、多くの種類の中和抗体がしっかりと産生されるため、免疫刷り込みが働いているのを見ることができないだけのことでしょう。
昔、こんなページも作っていました; 「抗原原罪の手抜き説明」:▶ ▶ ▶
さて、この先、細胞性免疫の話も出てきます。
「自然免疫」と「獲得免疫(細胞性免疫と液性免疫)」の違いがイマイチの方はコチラの「パット見てわかる説明」で再確認をお願いいたします:▶ ▶ ▶
また、「細胞性免疫」は「液性免疫(主役は抗体)」よりもウイルスの変異に強い理由をここで簡単に説明しておきます。
抗体はエピトープに結合します。エピトープはタンパクの場合、5~8個のアミノ酸が連なった短いペプチド(小さなタンパク)です。その5~8個のうち、1個が似たような電気的構造を持つアミノ酸に入れ替わっても抗体は結合できるかもしれませんが、そうでないときは1個のアミノ酸の入れ替えだけで結合できなくなる可能性があります。
(グリコのお兄さんのデビューページはコチラ「抗原原罪の手抜き説明」)
また、コロナウイルスの1個のスパイクは、約1300個のアミノ酸が連なり、複雑に折りたたまれており(折り畳まれるときに3つのスパイクが合体してひと塊になります:三量体)、その構造の一部としてエピトープがあるので、エピトープも立体構造を持っています。そのため、折れ曲がった状態の「あるエピトープ」と結合する抗体は、そのエピトープが真っ直ぐに伸びた状態だと強く結合できない可能性があります。
エピトープのアミノ酸配列順序だけでなく、その立体構造も抗体との結合力に影響します。
さらに、エピトープ自身のアミノ酸に変化が無くても、周りの隣接するアミノ酸の変化により電気的な影響を受けて抗体の結合力が弱まったり、スパイクに付いている糖鎖に結合を妨害される可能性もあります。

一方、細胞性免疫が識別するのは(液性免疫の抗体が認識するエピトープに相当するものは)、異種タンパクだと10数個のアミノ酸が連なった長いペプチド(小さなタンパク)です。その中の1個や2個のアミノ酸が変化したためにまったく認識できなくなることは少ないと考えられます。
(参照:細胞性免疫における感染細胞殺し:▶ ▶ ▶)
しかもスパイクの内部にある立体的な構造の状態で認識するのではなく、異種ペプチドのみが単独で切り出された状態で認識されるので、元のスパイクの中での立体構造の影響を受けませんし、もちろん周囲のアミノ酸変化の影響も受けません。
スパイクの変異の激しいコロナウイルスに対して、免疫系が(液性免疫に頼らないで)自然免疫と細胞性免疫に頼って身体の防衛を頑張るのは、理にかなったことなのです。
ただし液性免疫は、抗体に柔軟性を持たせるために体細胞超変異(somatic hypermutaion)という小技を使うことがあります。
要するに(同じ抗原刺激が続く場合にも)作る抗体に多様性を持たせ、ちょっとした変異ならカバーできるようにする小技が ハイパーミューテーション です。
しかし、コロナウイルスの免疫逃避能力の方が勝っていて、2歩も3歩も先へ変異していくので、この小技は大きな効果を得ることはできていないようです。
リンク元のページに戻るときは、ブラウザの「戻る(<)」機能をお使いください。次の「▶ ▶ ▶」を使っても戻れますが、リンク元ページを「新たに読み込む」ことになり通信量が大きくなります:リンク元へ戻る:▶ ▶ ▶
今いるところ;このウェブページは「Part 9.感染例 について」の「補足説明8:2度目の感染」の「主な検査結果」
1度目の感染報告に戻る場合はこちら:▶ ▶ ▶(補足説明の第7ページに戻る)